Exercícios sobre a camada de valência
Estes exercícios sobre a camada de valência exploram as formas de se determinar a quantidade de elétrons na camada mais externa de um átomo.
Perguntas
Questão: 1
Quantos elétrons de valência existem na configuração do elemento químico de número atômico 83?
a) 2
b) 3
c) 4
d) 5
e) 6
Questão: 2
Qual dos números atômicos a seguir corresponde a um elemento químico que apresenta em sua camada de valência 3 elétrons?
a) 6
b) 55
c) 32
d) 17
e) 49
Questão: 3
(UEFS-BA) O titânio é um metal utilizado na fabricação de motores de avião e pinos para prótese. Quantos elétrons há no último nível da configuração eletrônica desse metal? Dado: Ti (Z =22).
a) 6
b) 5
c) 4
d) 3
e) 2
Questão: 4
(Osec-SP) Sendo o subnível 4s1 (com um elétron) o mais energético de um átomo, podemos afirmar que:
I. O número total de elétrons deste átomo é igual a 19.
II. Este átomo apresenta 4 camadas eletrônicas.
III. Sua configuração eletrônica é: ls2 2s2 2p6 3s2 3p6 3d10 4s1
a) Apenas a afirmação I é correta;
b) Apenas a afirmação II é correta;
c) Apenas a afirmação III é correta;
d) As afirmações I e II são corretas;
e) As afirmações II e III são corretas.
Respostas
Questão: 1
Letra d). Para comprovar a alternativa d, há dois caminhos:
1o caminho: simples análise da tabela periódica.
O elemento 83 pertence às seguintes posições na tabela periódica:
-
6o período: o que caracteriza 6 níveis de energia;
-
Família VA (grupo 15): o que caracteriza 5 elétrons na camada de valência.
2o caminho: realizar a distribuição eletrônica.
Por meio da distribuição eletrônica do elemento de número 83 no diagrama de Linus Pauling, temos:

Assim, na sua camada de valência (último nível, que no caso é o 6o), existem 2 elétrons no subnível 6s2 e 3 elétrons no subnível 6p3, o que resulta em um total de 5 elétrons.
Questão: 2
Letra e). Para comprovar a alternativa e, podemos seguir dois caminhos:
1o caminho: simples análise da tabela periódica.
O elemento que possui 3 elétrons na camada de valência pertence obrigatoriamente à família IIIA ou ao grupo 13 da tabela periódica. Essa família apresenta elementos com os seguintes números atômicos:
-
5;
-
13;
-
31;
-
49;
-
81;
-
113.
2o caminho: realizar a distribuição eletrônica de cada um dos números atômicos fornecidos no exercício:

Esse elemento apresenta 4 elétrons em sua camada de valência (2o nível).

Esse elemento apresenta 1 elétron em sua camada de valência (6o nível).
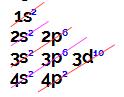
Esse elemento apresenta 4 elétrons em sua camada de valência (4o nível).
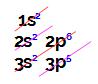
Esse elemento apresenta 7 elétrons em sua camada de valência (3o nível).

Esse elemento apresenta 3 elétrons em sua camada de valência (5o nível).
Questão: 3
Letra e). Para comprovar a alternativa e, há dois caminhos:
1o caminho: simples análise da tabela periódica.
O elemento 22 pertence às seguintes posições na tabela periódica:
-
4o período: caracterizado por 4 níveis de energia;
-
Família IIIIB (grupo 3): caracterizada por 2 elétrons na camada de valência, o que é comum para todo elemento da família B.
2o caminho: realizar a distribuição eletrônica.
Ao analisar a distribuição eletrônica do elemento de número 22 no diagrama de Linus Pauling, temos:
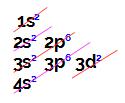
Assim, na sua camada de valência (último nível, nesse caso, o 4o), existem 2 elétrons no subnível 4s2, ou seja, 2 elétrons de valência.
Questão: 4
Letra d). O exercício fornece o subnível mais energético do átomo, ou seja, o local onde sua distribuição eletrônica termina. Com isso, podemos construir inicialmente o diagrama de Linus Pauling e realizar a distribuição eletrônica até o subnível indicado pelo enunciado:
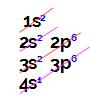
Ao analisar essa distribuição eletrônica, temos que:
-
O número de elétrons é 19;
-
Há quatro camadas eletrônicas.
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-camada-valencia.htm