Exercícios sobre a constante de ionização
Esta lista de exercícios sobre constante de ionização aborda situações em que essa variável física é utilizada para determinar a força de ácidos ou bases inorgânicas.
Perguntas
Questão: 1
Dadas as constantes de ionização dos ácidos abaixo:
Podemos afirmar que:
a) o ácido mais forte é o HCN.
b) o ácido mais forte é o HNO2.
c) o ácido mais forte é o H2SO4.
d) o ácido mais forte é o H3PO4.
e) n.d.a.
Questão: 2
Em um laboratório, um químico manipula dois frascos, sendo que cada um deles possui um ácido diferente. No rótulo do primeiro, está escrito ácido acético (H3CCOOH), cuja constante de ionização é de 1,8.10-5. No outro frasco, está escrito ácido hipocloroso (HClO), cuja constante de ionização é de 3,5.10-8. A partir dessas informações, o químico pôde concluir que:
a) uma solução de ácido hipocloroso contém mais íons hidrônio (H+) do que uma solução de ácido acético.
b) o ácido acético é mais forte que o ácido hipocloroso.
c) o ácido hipocloroso é mais solúvel que o ácido acético.
d) o ácido hipocloroso é mais forte que o ácido acético.
Questão: 3
(Udesc-SC) O grau de ionização (α) indica a porcentagem das moléculas dissolvidas na água que sofreram ionização, e a constante de ionização Ka indica se um ácido é forte, moderado ou fraco. Partindo desses pressupostos, escolha a alternativa abaixo que apresenta a ordem decrescente de ionização dos ácidos, considerando soluções aquosas a 1 mol/L: HCN (Ka = 6,1.10–10), HF (Ka = 6,3.10–4), CH3COOH (Ka = 1,8.10–5) e HClO4 (Ka = 39,8)
a) HCN > CH3COOH > HF > HClO4
b) HClO4 > CH3COOH > HF > HCN
c) HF > CH3COOH > HClO4 > HCN
d) HCN > HClO4 > HF > CH3COOH
e) HClO4 > HF > CH3COOH > HCN
Questão: 4
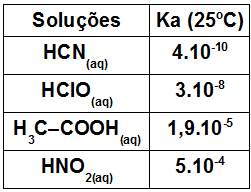
(UFTM-MG) Observe a tabela que considera volumes iguais de quatro soluções aquosas de ácidos com mesma concentração em quantidade de matéria (mol.L–1) e valores aproximados da constante de equilíbrio (Ka).
Sobre essas soluções, pode-se afirmar que:
a) o HClO(aq) é o mais ionizado.
b) o HCN(aq) é o que apresenta maior acidez.
c) o HNO2(aq) é o mais ionizado.
d) o H3C–COOH(aq) é o que apresenta maior acidez.
e) o HCN(aq) é o mais ionizado.
Respostas
Questão: 1
Letra c). Para determinar a força de um ácido a partir do valor da constante de ionização, basta compará-lo com outro. Quanto maior o valor da constante de ionização, mais forte será o ácido. De outra forma, quanto menor for a constante de ionização, menor será a força do ácido.
No exercício, o ácido sulfúrico (H2SO4) é o que apresenta maior força, já que sua potencia, 10-2, é a maior entre as opções fornecidas.
Questão: 2
Letra b). O exercício informa a constante de ionização de cada ácido que é uma variável utilizada para comparar a força, isto é, a capacidade de um ácido em produzir íons, quando dissolvido em água, com relação a outro. Quanto maior o valor da constante de ionização, mais forte será o ácido, e, em contrapartida, quanto menor for a constante de ionização, menor será a força do ácido.
No exercício, o ácido acético (H3CCOOH) é o que apresenta maior força, já que sua potencia, 10-5, é a maior entre as opções fornecidas.
Questão: 3
Letra e). Para colocar os ácidos referidos no exercício em ordem decrescente de força, basta analisar os valores das constantes de ionização fornecidas. Quanto maior o valor da constante de ionização, mais forte será o ácido. Em contrapartida, quanto menor for a constante de ionização, menor será a força do ácido.
No exercício, o ácido perclórico (HClO4) é o que apresenta maior força, já que sua potencia, 100, é a maior entre as opções fornecidas. O segundo mais forte é o ácido fluorídrico (HF), cuja potência é 10-4. Já o ácido mais fraco é o ácido cianídrico (HCN), cuja potência é 10-10.
Questão: 4
Letra c). O exercício informa a constante de ionização de cada ácido, que é uma variável utilizada para comparar a força, ou seja, a capacidade de produzir íons de um ácido, quando dissolvido em água, com relação a outro. Quanto maior o valor da constante de ionização, mais forte será o ácido, e, quanto menor for a constante de ionização, menor será a força do ácido.
No exercício, o ácido nitroso (HNO2) é o ácido que apresenta maior força (ou seja, tem maior capacidade de ionizar), já que sua potencia, 10-4, é a maior entre as opções fornecidas.
Fonte: Brasil Escola - https://exercicios.brasilescola.uol.com.br/exercicios-quimica/exercicios-sobre-constante-ionizacao.htm