Exercícios sobre a primeira lei para processos isotérmicos
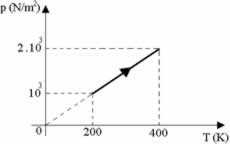
Suponha que dois mols de um certo gás sofram uma transformação conforme mostra o gráfico abaixo da pressão vs. temperatura. Sendo a constante universal dos gases R = 8,31 J/mol.K, o calor molar a volume constante Cv = 4 cal/mol.K e o equivalente mecânico 1 cal = 4,18 J, determine a variação da energia interna e marque a alternativa correta.
a) 8.866 J
b) 4.433 J
c) 6.975 J
d) 3.500 J
e) 6.688 J
n = 2 mols; Cv = 4 cal/mol.K; Ti = 200 K; Tf = 400 K; 1 cal = 4,18 J
ΔT = Tf – Ti ΔT = 400 – 200 ΔT = 200 K
Q=n.Cv.∆T
Q=2 .4 .200
Q=6.688 J
A variação da energia interna é dada por:
Q=∆U+τ
Q=∆U
∆U=6.688 J
Alternativa E
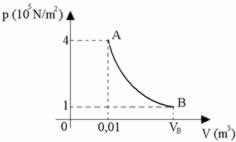
Uma determinada massa gasosa sofre uma transformação isotérmica, conforme o diagrama, e recebe do meio externo, em forma de calor, 2000 J. Dada a constante universal dos gases R = 8,31 J/mol.K, determine respectivamente o volume final, a variação da energia interna e o trabalho realizado pelo gás e marque a alternativa correta.
a) 0,04 m3, 200 J, 100 J
b) 0,04 m3, 10 J, 5 J
c) 0,04 m3, 0 J, 3200 J
d) 0,04 m3, 0 J, 2000 J
e) 0,04 m3, 200 J, 200 J
Retirando os dados:
PA = 4 . 105 N/m2; VA = 0,01 m3; PB = 105 N/m2; Q = 2000 J
Numa transformação isotérmica, temos:
pA.VA=pB.VB
4 .105.0,01= 105 .VB
VB=0,04 m3
Na transformação isotérmica não há variação de temperatura, portanto:
TA=TB
∆T=0 ⟹ ∆U=0
Calculando o trabalho:
Q=∆U+τ
τ=Q
τ=2.000 J
Alternativa D
(UFRN) Um sistema termodinâmico realiza um trabalho de 40 kcal quando recebe 30 kcal de calor. Nesse processo, a variação de energia interna desse sistema é de:
a) – 10 kcal
b) zero
c) 10 kcal
d) 20 kcal
e) 35 kcal
De acordo com a primeira lei da termodinâmica:
Q=∆U+τ
∆U=Q-τ
∆U=30 kcal-40 kcal
∆U=-10 kcal
Alternativa A
(FMPA-MG) Sobre um gás confinado em condições ideais podemos afirmar corretamente que:
a) numa compressão isotérmica o gás cede calor para o ambiente.
b) aquecendo o gás a volume constante sua energia interna permanece constante.
c) numa expansão adiabática, a temperatura do gás aumenta.
d) numa expansão isobárica, a temperatura do gás diminui.
e) quando o gás sofre transformações num ciclo, o trabalho resultante que ele realiza é nulo.
a) Correta – na transformação isotérmica, a temperatura do sistema é constante, portanto a variação da energia interna é nula. Isso significa que o calor e o trabalho trocados com o meio externo têm valores iguais, portanto o gás cede calor para o ambiente.
b) Errada – na transformação isovolumétrica, o volume permanece constante, portanto não há realização de trabalho pelo gás. Isso significa que a variação da energia interna sofrida pelo sistema gasoso tem valor igual ao do calor trocado com o meio externo.
c) Errada – nas transformações adiabáticas não há troca de calor entre o sistema e o ambiente. Portanto, toda energia recebida ou cedida pelo sistema ocorre por meio de trabalho. Isso significa que a variação da energia interna sofrida pelo gás é igual ao trabalho que o sistema troca com o meio ambiente. Sendo assim, em uma expansão adiabática a temperatura e a pressão diminuem e não aumentam.
d) Errada – na transformação isobárica, a pressão do sistema gasoso mantém-se constante. Nesse tipo de transformação, quando o volume expande (aumenta), a temperatura dos sistemas também aumenta e não diminui como proposto pela questão.
e) Errada – nas transformações cíclicas, o sistema sempre realiza e recebe trabalho, sendo o trabalho total a soma desses trabalhos parciais. O que é nulo em uma transformação cíclica é a energia interna.
Alternativa A






