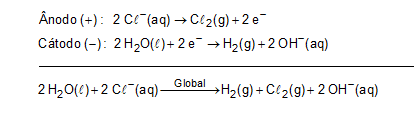Enem: lista de exercícios sobre eletrólise
Nesta lista de exercícios, você testará o que aprendeu sobre eletrólise, processo físico-químico que sempre é abordado na prova de Química do Enem.
Publicado por: Murilo XovenQuestões
-
Questão 1
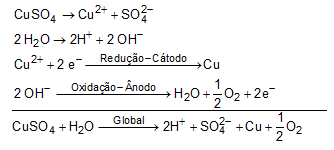
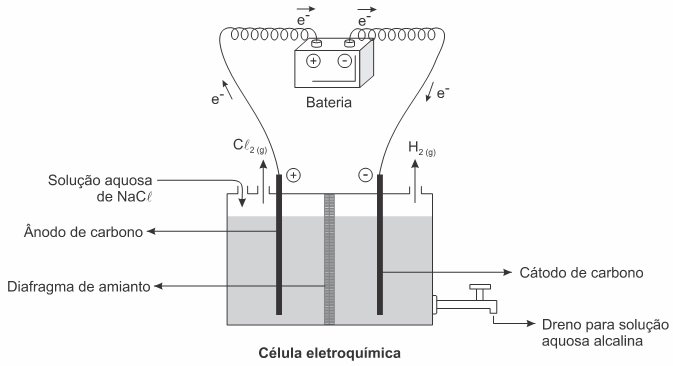
(Enem 2017 — adaptada) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
No processo eletrolítico ilustrado, tem-se a seguinte reação global:
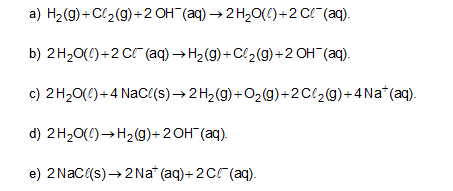
-
Questão 2
(Enem 2017) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
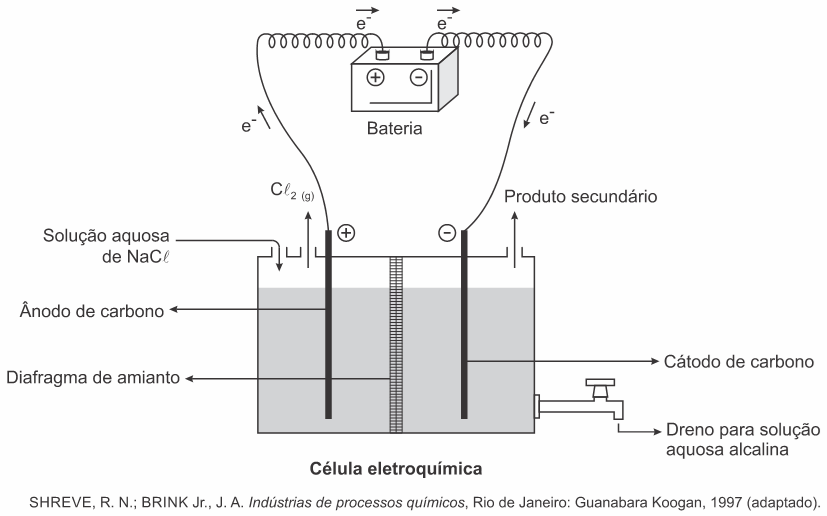
No processo eletrolítico ilustrado, o produto secundário obtido é o
a) vapor de água.
b) oxigênio molecular.
c) hipoclorito de sódio.
d) hidrogênio molecular.
e) cloreto de hidrogênio.
Letra D
Eletrólise de uma solução aquosa de NaCl:
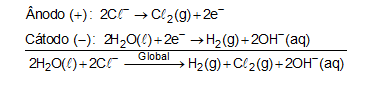
Produto secundário: H2 (g).
-
Questão 3
(Enem 2013) Eu também podia decompor a água, se fosse salgada ou acidulada, usando a pilha de Daniell como fonte de força. Lembro o prazer extraordinário que sentia ao decompor um pouco de água em uma taça para ovos quentes, vendo-a separar-se em seus elementos, o oxigênio em um eletrodo, o hidrogênio no outro. A eletricidade de uma pilha de 1 volt parecia tão fraca, e, no entanto podia ser suficiente para desfazer um composto químico, a água…
SACKS, O. Tio Tungstênio: memórias de uma infância química. São Paulo: Cia. das Letras, 2002.
O fragmento do romance de Oliver Sacks relata a separação dos elementos que compõem a água. O princípio do método apresentado é utilizado industrialmente na
a) obtenção de ouro a partir de pepitas.
b) obtenção de calcário a partir de rochas.
c) obtenção de alumínio a partir da bauxita.
d) obtenção de ferro a partir de seus óxidos.
e) obtenção de amônia a partir de hidrogênio e nitrogênio.
Letra C
O processo abordado no texto refere-se a uma eletrólise (decompor a água caso fosse salgada ou acidulada, usando a pilha de Daniell como fonte de força). O alumínio pode ser obtido industrialmente a partir do minério bauxita por uma eletrólise ígnea, como demonstrado abaixo:
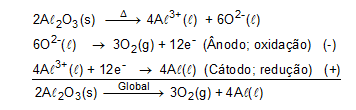
-
Questão 4
(Enem 2010) A eletrólise é muito empregada na indústria com o objetivo de reaproveitar parte dos metais sucateados. O cobre, por exemplo, é um dos metais com maior rendimento no processo de eletrólise, com uma recuperação de aproximadamente 99,9%. Por ser um metal de alto valor comercial e de múltiplas aplicações, sua recuperação torna-se viável economicamente.
Suponha que, em um processo de recuperação de cobre puro, tenha-se eletrolisado uma solução de sulfato de cobre (II) (CuSO4) durante 3 h, empregando-se uma corrente elétrica de intensidade igual a 10A. A massa de cobre puro recuperada é de aproximadamente
Dados: Constante de Faraday F = 96 500 C/mol; Massa molar em g/mol: Cu = 63,5.
a) 0,02g.
b) 0,04g.
c) 2,40g.
d) 35,5g.
e) 71,0g.
Letra D
Q = i x t ⇒ 10 x 3 x 3600 s = 108000 C
Cu2+ + 2e- → Cu
2 x 96500 C — 63,5 g
108000 C — m
m = 35,53 g
-
Questão 5
(Enem Digital 2020) As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas que atuam como uma célula galvânica, enquanto estão sendo descarregadas, e como célula eletrolítica, quando estão sendo recarregadas.
Uma pilha é formada pelos elementos níquel e cádmio e seu carregador deve fornecer uma diferença de potencial mínima para promover a recarga. Quanto maior a diferença de potencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencial padrão de redução dessas espécies:
Ni2+ (aq) + 2 e− ⇌ (s) E° = −0,230 V
Cd2+ (aq) + 2 e− ⇌ Cd (s) E° = −0,402 V
Teoricamente, para que um carregador seja ao mesmo tempo eficiente e tenha o menor preço, a diferença de potencial mínima, em volt, que ele deve superar é de
a) 0,086.
b) 0,172.
c) 0,316.
d) 0,632.
e) 1,264.
Letra B
O texto afirma que quanto maior a diferença de potencial gerada pelo carregador, maior será o seu custo. Devemos encontrar a diferença de potencial mínima para que seja feita a recarga da pilha. Portanto, deve ser uma diferença de potencial igual à gerada pela pilha a seguinte:
∆E = Emaior – Emenor
∆Eo = – 0,230 – (– 0,402)
∆Eo = 0,172 V
-
Questão 6
(Enem PPL 2015) O alumínio é um metal bastante versátil, pois, a partir dele, podem-se confeccionar materiais amplamente utilizados pela sociedade. A obtenção do alumínio ocorre a partir da bauxita, que é purificada e dissolvida em criolita fundida (Na3AℓF6) e eletrolisada a cerca de 1.000 ºC. Há liberação do gás dióxido de carbono (CO2), formado a partir da reação de um dos produtos da eletrólise com o material presente nos eletrodos. O ânodo é formado por barras de grafita submergidas na mistura fundida. O cátodo é uma caixa de ferro coberta de grafita. A reação global do processo é:
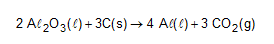
Na etapa de obtenção do alumínio líquido, as reações que ocorrem no cátodo e ânodo são:

Letra A
A partir da análise da equação química fornecida pelo enunciado da questão, temos:
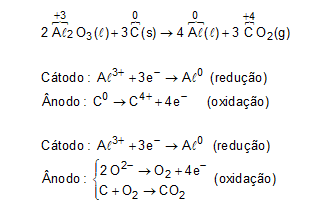
-
Questão 7
(Enem PPL 2011) A matéria-prima básica para a fabricação de calçados plásticos é a resina de PVC. A seguir é apresentado o fluxograma de fabricação do PVC e sua fórmula química.
Siglas: PVC — policloreto de vinila; EDC — dicloro etano; MVC — monocloreto de vinila
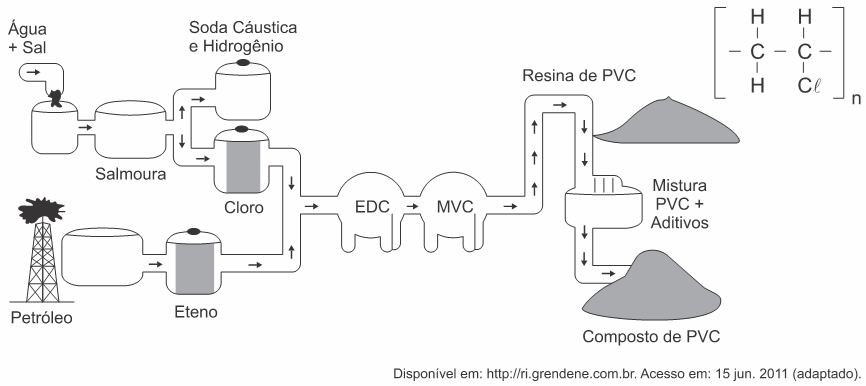
Para a produção do PVC, a obtenção do cloro é proveniente do processo de
a) destilação.
b) eletrólise.
c) fusão ígnea.
d) filtração a vácuo.
e) precipitação fracionada.
Letra B
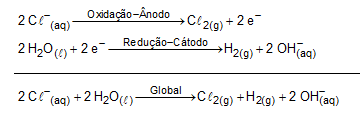
A produção do PVC necessita de gás cloro, e podemos notar que em uma das etapas iniciais do processo há a confecção de salmoura. Logo após isso, acontece a produção de gás cloro. Pressupomos, então, que ocorre uma eletrólise aquosa do NaCl:
-
Questão 8
(EsPCEx 2021) Nestes últimos anos, os alunos da EsPCEx têm realizado uma prática no laboratório de química envolvendo eletrólise com eletrodos inertes de grafite. Eles seguem um procedimento experimental conforme a descrição: - Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 ml de solução aquosa de sulfato de zinco (ZnSO4) de concentração 1 mol·L-1. Tome como eletrodos duas barras finas de grafite. Ligue-as com auxílio de fios a uma fonte externa de eletricidade (bateria) com corrente de 2 Ampères. Essa fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. Uma das barras deve ser ligada ao polo negativo da fonte e a outra barra, ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 32 minutos e 10 segundos e observe.
Considere o arranjo eletrolítico (a e conforme visto na figura a seguir:
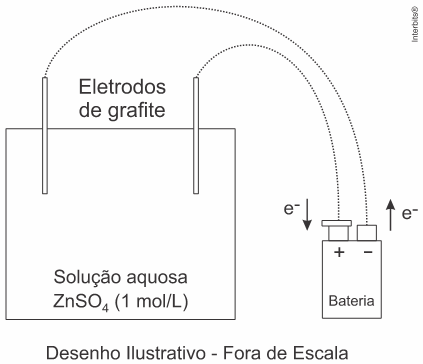
Dados: 1 Faraday (F) = 96500 Coubomb (C)/mol de elétrons; Zn = 65,4.
Acerca do experimento e os conceitos químicos envolvidos, são feitas as seguintes afirmativas:
I. Na superfície da barra de grafite ligada como cátodo da eletrólise ocorre a eletrodeposição do zinco metálico.
II. A semirreação de oxidação que ocorre no ânodo da eletrólise é Zn(s) → Zn2+(aq) + 2 e-.
III. Durante o processo a barra de grafite ligada ao polo positivo da bateria se oxida.
IV. No ânodo da eletrólise ocorre uma reação de oxidação da hidroxila com formação do gás oxigênio e água.
V. A massa de zinco metálico obtida no processo de eletrólise será de
Das afirmativas feitas, estão corretas apenas
a) I e IV.
b) I, III e IV.
c) I e V.
d) II e III.
e) III, IV e V.
Letra A
I. Verdadeira. Na barra de grafite ligada como cátodo da eletrólise, ocorre a eletrodeposição do zinco sólido (metálico):
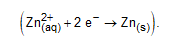
II. Falsa. A semirreação de oxidação ocorrida no ânodo é:
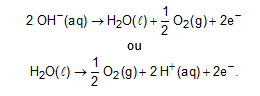
III. Falsa. Durante o processo, a barra de grafite ligada ao polo positivo da bateria não se oxida, pois trata-se de um eletrodo inerte.
IV. Verdadeira. No ânodo da eletrólise, acontece uma reação de oxidação da oxidrila com formação de O2(g) e H2O(l).
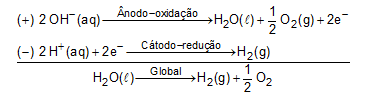
V. Falsa. A massa de zinco metálico obtida na eletrólise será de 1,3 g.

-
Questão 9
(FMP 2020) A galvanostegia é um processo químico que consiste na aplicação, mediante deposição eletrolítica, de revestimentos metálicos aderentes, para modificar as propriedades ou as dimensões da superfície de um metal. Ela pode melhorar o aspecto, a dureza ou a resistência à corrosão e à formação de manchas superficiais.
Nos processos de galvanostegia, o objeto a ser tratado é imerso em uma solução que contenha o metal a ser depositado, sob a forma de íons, sejam simples ou complexos.
Disponívelem:<https://editorarealize.com.br/revistas/conapesc/trabalhos/TRABALHO_EV058_MD1_SA86_ID1941_17052016200759.pdf>. Acesso em: 22 jul. 2019. Adaptado.
Sabe-se que o objeto a ser niquelado é ligado eletricamente ao polo negativo de um gerador com corrente contínua.
Sendo assim, admite-se que a reação que ocorre no cátodo seja representada por
a) Ni+2 → Ni0 +2 e-
b) Ni0 → Ni+3 + 3 e-
c) Ni0 + 2 e- → Ni+2
d) Ni0 → Ni+2 +2 e-
e) Ni+2 +2 e- → Ni0
Letra E
No processo de niquelação, a reação que ocorre no cátodo é de redução do Ni+2: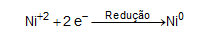
-
Questão 10
(EsPCEx 2020) Neste ano de 2019, foi realizada pelos alunos da EsPCEx uma prática no laboratório de química envolvendo eletrólise com eletrodos ativos conforme a descrição experimental:
- Num béquer de capacidade 100 ml (cuba eletrolítica) coloque cerca de 50 ml de solução aquosa de sulfato de cobre II de concentração 1 mol·L-1 Tome como eletrodos uma barra fina de cobre e um prego de ferro. Ligue-os com auxílio de fios a uma fonte externa de eletricidade com uma corrente contínua de intensidade de 3 Ampères. Essa fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. O prego deve ser ligado ao polo negativo da fonte e a barra de cobre, ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 16 minutos e 5 segundos e observe.
Considere o arranjo eletrolítico (a 25 °C e 1 atm) e o sal completamente dissociado, conforme visto na figura a seguir:
Dados: 1 Faraday (F) = 96.500 Coulomb (C) /mol de elétrons; Cu = 63,5.
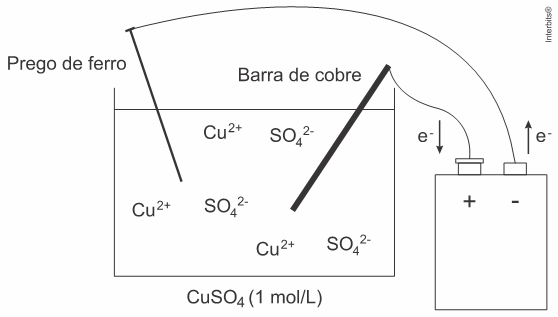
Na discussão apresentada nos relatórios dos diversos grupos de alunos, surgiram as seguintes afirmativas:
I. Na superfície do prego ocorreu a deposição de cobre metálico.
II. Durante o processo a barra de cobre se oxida.
III. A massa de cobre metálico que se depositou na superfície do prego foi de 2,45 g.
IV. A semirreação de redução que ocorre no cátodo é Cu²⁺ + 2 e⁻ Cu°.
V. A reação global é Fe²⁺ + Cu° Fe° + Cu²⁺.
Assinale a alternativa que apresenta todas as afirmativas corretas dentre as listadas acima.
a) I, II e IV.
b) II, III e V.
c) I, IV e V.
d) I, II, III e IV.
e) I, II e V.
Letra A
I. Verdadeira. Na superfície do prego, ocorre a deposição de cobre metálico:

II. Verdadeira. Durante o processo, a barra de cobre se oxida (os elétrons vão do ânodo (+) para o cátodo (–)).
III. Falsa. A massa de cobre metálico que se depositou na superfície do prego foi de 0,95 g.

IV. Verdadeira. A semirreação de redução (cátodo) é Cu2+ (aq) +2 e- → Cu0.
V. Falsa. A reação global é: