Exercícios sobre Baterias de Chumbo
Nas baterias de chumbo usadas em automóveis, o ânodo é feito de chumbo, e o cátodo, de óxido de chumbo IV, ambos mergulhados em uma solução de ácido sulfúrico.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Na bateria de um automóvel, ocorre a seguinte reação de descarga:
Pb(s) + PbO2(s) + 4 H+ (aq) + 2 SO42-(aq) ↔ 2 PbSO4(s) + 2 H2O(ℓ)
Dê a razão pela qual a densidade da solução diminui:
-
A densidade diminui porque não há íons dissolvidos depois da descarga.
-
A densidade diminui porque o chumbo é bastante denso e ele é consumido.
-
A densidade diminui porque há a diminuição de ácido sulfúrico e aumento de água.
-
A densidade diminui porque há a diminuição de óxido de chumbo IV e aumento de sulfato de chumbo.
-
A densidade diminui porque há aumento da solução de ácido sulfúrico.
Alternativa “c”.
A densidade do ácido sulfúrico ajuda a identificar se a bateria está descarregada. Visto que sua densidade é 1,28g/cm3, se esse valor estiver abaixo de 1,20 g/cm3, significa que o ácido sulfúrico foi consumido e a bateria está descarregada.
-
-
Questão 2
Sabendo que uma bateria de automóvel é constituída de seis pilhas ligadas em série, qual é a voltagem que essa bateria produz?
São dadas as semirreações no ânodo e no cátodo:
Ânodo: Pb(s) + SO42-(aq) → PbSO4(s) + 2e- E0 = + 0,35 V
Cátodo: PbO2(s) + 4 H+(aq) + + SO42-(aq) + 2e- → PbSO4(s) + 2 H2O(ℓ) E0 = + 1,68 V
-
2,03 V
-
12 V
-
1,33 V
-
6 V
-
0,58 V
Alternativa “b”.
ΔE0 = E0oxi + E0red
ΔE0 = 0,35 + 1,68
ΔE0 = 2,03 VEsse valor corresponde à voltagem de uma só pilha. Como são seis, a voltagem da bateria será aproximadamente 12 V.
-
-
Questão 3
(Unb-DF) A bateria de automóveis possui dois tipos de eletrodos (de PbO e de Pb0), mantidos em solução aquosa de ácido sulfúrico, H2SO4(aq).A equação correspondente à reação envolvida na geração de energia é:
PbO2 + Pb0 + 2 H2SO4 → 2 PbSO4 + 2 H2O
Julgue os itens:
- Nos eletrodos de PbO2 ocorre oxidação.
- O elemento chumbo sofre oxidação nos eletrodos de Pb0 e redução nos eletrodos de PbO2.
- O estado de oxidação do chumbo no PbO2 é +4.
- Nos eletrodos de Pb0 há perda de elétrons.
- Falso. Conforme mostra a semirreação abaixo, nos eletrodos de PbO2(s), ocorre redução, pois o cátion chumbo IV, Pb4+, ganha dois elétrons, formando o cátion chumbo II, Pb2+.
Cátodo: PbO2 + HSO41-+ 3H3O1+ + 2e-↔ PbSO4 + 5 H2O
-
V.
-
V.
-
V.
-
Questão 4
(UFMG) Uma bateria de automóvel é constituída de uma sequência de células em que ocorre a reação (Dado: E0 = 2 V):
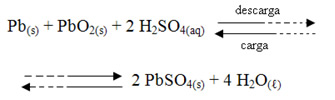
Numa bateria nova, a solução de H2SO4 tem densidade de 1,3 g/mL. Com relação a esse sistema, estão certas as afirmações a seguir, exceto:
-
A fase líquida da bateria é corrosiva.
-
Durante a carga, o PbSO4 é, simultaneamente, agente oxidante e redutor.
-
Durante a descarga, a densidade do eletrólito diminui.
-
Durante a descarga, o ânodo de uma célula é constituído de PbO2.
-
Durante a descarga, a voltagem da bateria diminui.
Alternativa “d”.
Durante a descarga, o ânodo são as placas de chumbo (Pb):
Ânodo: Pb +HSO41-+ H2O ↔ PbSO4 + H3O1+ + 2e-
O cátodo que é constituído de PbO2:
Cátodo: PbO2 + HSO41-+ 3H3O1+ + 2e-↔ PbSO4 + 5 H2O
-