Exercícios sobre cálculo de massa atômica
Esta lista de exercícios aborda o cálculo da massa atômica e apresenta diferentes situações em que essa unidade ou porcentagem é determinada.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Um determinado elemento hipotético Y (que apresenta massa atômica igual a 74,8u), assim como todos os outros elementos químicos naturais, é formado por um grupo de isótopos. Em seu caso, são conhecidos dois isótopos, os quais apresentam massas atômicas igual a 74 e 79, respectivamente. A partir dessas informações, determine o valor das abundâncias de cada um dos seus dois isótopos na natureza.
a) 39% e 61%
b) 61% e 39%
c) 84% e 16%
d) 16% e 84%
e) 54% e 46%
Letra c). Os dados fornecidos pelo exercício foram:
-
Massa molar do isótopo 1: 74 u
-
Abundância do isótopo 1: x %
-
Massa molar do isótopo 2: 79 u
-
Abundância do isótopo 2: y %
-
Massa molar do elemento na tabela: 74,8 u
Para determinar o valor das abundâncias de cada um dos dois isótopos, devemos realizar os seguintes passos:
1º Passo: Trabalhar a abundância dos isótopos.
Como o elemento apresenta apenas dois isótopos naturais, logo, a somatória das abundâncias de seus isótopos deve ser igual a 100%. Assim:
x + y = 100%
ou
x = 100 – y
2º Passo: Utilizar os dados na expressão para cálculo da massa atômica.
M.A. = Massa do isótopo 1. abundância + massa do isótopo 2. abundância
10074,8 = 74.x + 79.y
10074,8.100 = 74x + 79y
7480 = 74.(100 – y) + 79y
7480 = 7400 – 74y + 79y
7480 - 7400 = – 74y + 79y
80 = 5y
80 = y
5y = 16%
3º Passo: Utilizar os dados fornecidos para calcular a abundância do isótopo 1:
x = 100 – y
x = 100 – 16
x = 84%
-
-
Questão 2
A tabela a seguir apresenta os três isótopos naturais do elemento químico magnésio, os quais são encontrados na natureza em diferentes proporções.
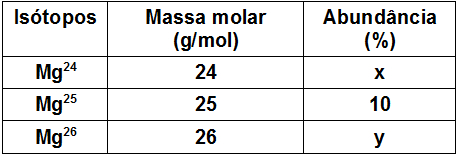
A partir dos dados fornecidas pela tabela, podemos concluir que a abundância do isótopo de massa 26 é igual a:
a) 30
b) 20
c) 15
d) 10
e) 25
Letra d). Os dados fornecidos pelo exercício foram:
-
Massa molar do isótopo 1: 24 u
-
Abundância do isótopo 1: x %
-
Massa molar do isótopo 2: 25 u
-
Abundância do isótopo 2: 10 %
-
Massa molar do isótopo 3: 26 u
-
Abundância do isótopo 3: y %
-
Massa molar do elemento na tabela: 24,3 u
Para determinar o valor das abundâncias de cada um dos dois isótopos, devemos realizar os seguintes passos:
1º Passo: Trabalhar a abundância dos isótopos.
Como o elemento apresenta apenas três isótopos naturais, logo, a somatória das abundâncias de seus isótopos deve ser igual a 100%. Assim:
x + 10 + y = 100%
x + y = 100 – 10
x + y = 90
ou
x = 90 – y
2º Passo: Utilizar os dados na expressão para cálculo da massa atômica.
M.A. = Massa do isótopo 1. abundância + massa do isótopo 2. abundância
10024,3 = 24.x + 25.10 + 26.y
10024,3.100 = 24x + 250 + 26y
2430 = 24.(90 – y) + 250 + 26y
2430 = 2160 – 24y + 26y
2430 – 2160 - 250 = 2y
20 = 2y
20 = y
2y = 10 %
-
-
Questão 3
(Uerj) Em 1815, o médico inglês William Prout formulou a hipótese de que as massas atômicas de todos os elementos químicos corresponderiam a um múltiplo inteiro da massa atômica do hidrogênio. Já está comprovado, porém, que o cloro possui apenas dois isótopos e que sua massa atômica é fracionária. Os isótopos do cloro, de massas atômicas 35 e 37, estão presentes na natureza, respectivamente, nas porcentagens de:
a) 55% e 45%
b) 65% e 35%
c) 75% e 25%
d) 85% e 15%
Letra c). Os dados fornecidos pelo exercício foram:
-
Massa molar do isótopo 1: 35 u
-
Abundância do isótopo 1: x %
-
Massa molar do isótopo 1: 37 u
-
Abundância do isótopo 2: y %
-
Massa molar do elemento na tabela: 35,5 u
Para determinar o valor das abundâncias de cada um dos dois isótopos, devemos realizar os seguintes passos:
1º Passo: Trabalhar a abundância dos isótopos.
Como o elemento apresenta apenas dois isótopos naturais, logo, a somatória das abundâncias de seus isótopos deve ser igual a 100%. Assim:
x + y = 100%
ou
x = 100 – y
2º Passo: Utilizar os dados na expressão para cálculo da massa atômica.
M.A. = Massa do isótopo 1. abundância + massa do isótopo 2. abundância
10035,5 = 35.x + 37.y
10035,5.100 = 35x + 37y
3550 = 35.(100 – y) + 37y
3550 = 3500 – 35y + 37y
3550 - 3500 = – 35y + 37y
50 = 2y
80 = y
2y = 25 %
3º Passo: Utilizar os dados fornecidos para calcular a abundância do isótopo 1:
x = 100 – y
x = 100 – 25
x = 75%
-
-
Questão 4
(PUC-RJ) Oxigênio é um elemento químico que se encontra na natureza sob a forma de três isótopos estáveis: oxigênio 16 (ocorrência de 99%); oxigênio 17 (ocorrência de 0,60%) e oxigênio 18 (ocorrência de 0,40%). A massa atômica do elemento oxigênio, levando em conta a ocorrência natural dos seus isótopos, é igual a:
a) 15,84
b) 15,942
c) 16,014
d) 16,116
e) 16,188
Letra c). Os dados fornecidos pelo exercício foram:
-
Massa molar do isótopo 1: 16 u
-
Abundância do isótopo 1: 99 %
-
Massa molar do isótopo 2: 17 u
-
Abundância do isótopo 2: 0,6 %
-
Massa molar do isótopo 3: 18 u
-
Abundância do isótopo 3: 0,4 %
-
Massa molar do elemento na tabela: ?
Passo: Utilizar os dados na expressão para cálculo da massa atômica.
M.A. = Massa do isótopo 1. abundância + massa do isótopo 2. abundância + massa do 3
100M.A.= 16.99 + 17.0,6 + 18.0,4
100M.A.= 1584 + 10,2 + 7,2
100M.A. = 1601,4
100M.A. = 16,014 u
-