Exercícios sobre Catalisadores
Os catalisadores são compostos capazes de aumentar a velocidade de uma reação química, sem participar dela, por meio do abaixamento da energia de ativação.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Catalisador é toda substância que aumenta a taxa de desenvolvimento de determinadas reações químicas sem, contudo, participar dos produtos da reação, sendo integralmente recuperado no final, tanto em massa quanto na composição. Os catalisadores conseguem aumentar a velocidade das reações porque:
-
Com a presença do catalisador, a concentração aumenta, ou seja, aumenta o número de partículas por unidade de volume e, consequentemente, o número de choques efetivos será maior.
-
Com o catalisador, há mais choques efetivos, aumentando a energia cinética das partículas, aumentando a temperatura do sistema, que faz a reação se processar mais rápido.
-
O catalisador aumenta o número de partículas por unidade de volume e, consequentemente, a pressão aumenta, aumentando a taxa de desenvolvimento da reação.
-
O catalisador participa da formação do complexo ativado, fazendo com que os reagentes necessitem de uma energia de ativação menor para atingir esse estado, aumentando, dessa forma, a taxa de desenvolvimento da reação.
-
O catalisador tem afinidade com todos os reagentes, ligando-se a todos eles e aumentando a velocidade com que eles se ligam.
Alternativa “d”.
-
-
Questão 2
Observe o gráfico de uma reação efetuada com e sem catalisador:
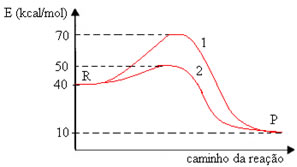
Relacione as colunas abaixo:
- A curva que corresponde à reação com catalisador. ( ) – 30 kcal/mol.
- A curva que corresponde à reação sem catalisador. ( ) 70 kcal/mol.
- Valor da energia do complexo ativado com catalisador. ( ) 30 kcam/mol
- Valor da energia do complexo ativado sem catalisador. ( ) 1.
- Valor da energia de reação. ( ) 10 kcal/mol.
- Valor da energia de ativação da reação com catalisador. ( ) 2.
- Valor da energia de ativação da reação sem catalisador. ( ) 50 kcal.mol.
- A curva que corresponde à reação com catalisador. (V) – 30 kcal/mol.
- A curva que corresponde à reação sem catalisador. (IV) 70 kcal/mol.
- Valor da energia do complexo ativado com catalisador. (VII) 30 kcal/mol.
- Valor da energia do complexo ativado sem catalisador. (II) 1.
- Valor da energia de reação. (VI) 10 kcal/mol.
- Valor da energia de ativação da reação com catalisador. (I) 2.
- Valor da energia de ativação da reação sem catalisador. (III) 50 kcal/mol.
-
Questão 3
(Vunesp-SP) A hidrólise do brometo de metila pode ser representada pela equação abaixo e pelo gráfico a seguir:
1 CH3Br(ℓ) + 2 H2O(ℓ) → 1 CH3OH(ℓ) + 1 H3O1+(aq) + 1 Br1-(aq)
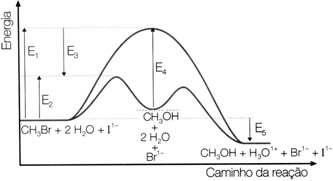
Com relação a essa reação, assinale a alternativa que contém a afirmação incorreta.
a) O íon I1-(aq) é catalisador da reação, que se processa com liberação de calor.
b) E4 é a energia de ativação do catalisador, que é o I1-(aq).
c) E3 é o abaixamento de energia de ativação devido ao catalisador.
d) E5 é a variação de entalpia da reação, que é exotérmica.
e) E1 é a energia de ativação sem catalisador e E2 é a energia de ativação com catalisador.
Alternativa “b”.
E4 corresponde ao abaixamento da energia de ativação da reação que ocorre na presença de catalisador.
-
Questão 4
(UMC-SP) Analise o gráfico de energia abaixo, obtido de uma mesma reação química. Uma reação foi feita com catalisador e outra sem catalisador.
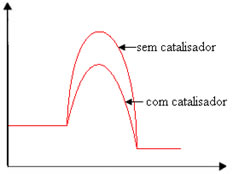
Assinale a afirmativa correta:
-
A reação é exotérmica devido ao catalisador empregado.
-
A entalpia da reação modificou-se devido ao emprego do catalisador.
-
A energia de ativação da reação diminuiu devido ao emprego do catalisador.
-
A reação é endotérmica devido ao emprego do catalisador.
-
O catalisador não teve efeito algum na energia de ativação da reação.
Alternativa “c”.
Com adição do catalisador, houve diminuição da energia de ativação.
-