Exercícios sobre classificação de carbono
Resolva esta lista de exercícios sobre classificação carbonos, um tópico essencial nos estudos introdutórios de Química Orgânica.
Publicado por: Stéfano Araújo NovaisQuestões
-
Questão 1
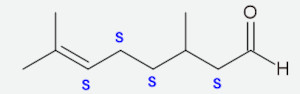
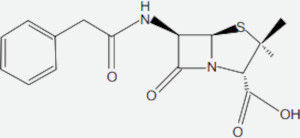
(Famerp) A penicilina G (C16H18N2O4S) foi a primeira molécula empregada para a inibição do crescimento de bactérias. Sua fórmula estrutural é representada na figura.
(Samira Norzaee et al. The Scientific World Journal, no 1, 2017.)
Na molécula da penicilina G há um heteroátomo que pertence ao grupo 16 da Classificação Periódica ligado a dois átomos de carbono que são classificados, respectivamente, como
A) primário e secundário.
B) secundário e quaternário.
C) secundário e terciário.
D) terciário e quaternário.
E) primário e terciário.
Alternativa E.
O heteroátomo do grupo 16 em questão é o enxofre (S). O átomo à esquerda é primário, pois só está ligado a um átomo de carbono. Já o átomo à direita é terciário, pois se liga a três átomos de carbono.
-
Questão 2
(Uece) A hibridização do carbono é extremamente importante na química orgânica, pois mostra como os átomos de carbono podem rearranjar seus elétrons de valência para formar híbridos de orbitais atômicos que permitem a formação de ligações químicas em compostos orgânicos. Essa reorganização dos elétrons acontece para que a molécula alcance uma geometria ideal e, assim, maximizar a estabilidade molecular. Atente para a seguinte estrutura com os átomos de carbono numerados de 1 a 4.
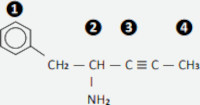
Na estrutura acima apresentada, os átomos de carbono com a numeração 1, 2, 3 e 4 são, respectivamente,
- sp2, sp3, sp4, sp3.
- sp, sp2, sp3, sp.
- sp2, sp3, sp, sp3.
- sp3, sp2, sp, sp3.
Alternativa C.
O carbono 1 é sp2, pois realiza uma ligação dupla e duas ligações simples.
O carbono 2 é sp3, pois realiza quatro ligações simples.
O carbono 3 é sp, pois realiza uma ligação tripla e uma ligação simples.
O carbono 4 é sp3, pois realiza quatro ligações simples.
-
Questão 3
(USS) Observe a seguir a fórmula estrutural do diazepam, fármaco amplamente empregado em tratamentos de ansiedade, convulsões e insônia devido ao seu efeito calmante:
A quantidade de átomos de carbono com hibridação sp2 nesse fármaco é igual a:
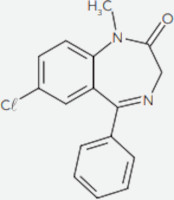
A) 10
B) 12
C) 14
D) 16
Alternativa C.
Carbonos sp2 são os que fazem uma ligação dupla e duas ligações duplas. São marcados na imagem a seguir.
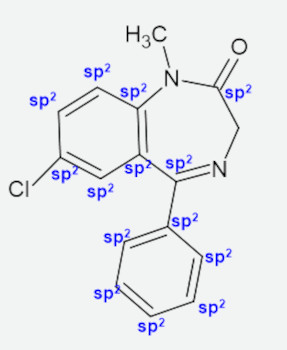
-
Questão 4
(Fame) A molécula buckminsterfulereno, C60, tem estrutura altamente simétrica, na qual 60 átomos de carbono se ligam, proporcionando uma geometria similar à de uma bola de futebol. O nome fulereno, atribuído à molécula de C60, indica que cada átomo de carbono está covalentemente ligado a três outros, ao invés de no máximo quatro, situação que classicamente corresponde à existência de ligações duplas entre carbonos.
Nesse contexto, a hibridação dos carbonos da molécula C60 será do tipo
A) sp.
B) sp2.
C) sp3.
D) sp3d.
Alternativa B.
Segundo o texto, o carbono do fulereno está covalentemente ligado a três outros, situação que corresponde às ligações duplas entre carbonos. Assim sendo, como o carbono faz quatro ligações, se está ligado covalentemente a três átomos, sendo uma ligação dupla, as outras duas ligações são simples, o que configura um átomo de hibridização sp2.
-
Questão 5
Observe a estrutura a seguir, que representa o 2,2,4-trimetilpentano, um dos principais componentes da gasolina comercial.
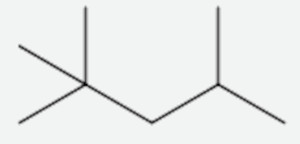
O número de carbonos primários, secundários, terciários e quaternários é, respectivamente:
A) 4, 2, 2, 0.
B) 5, 1, 1, 1.
C) 3, 2, 1, 2.
D) 1, 3, 3, 1.
E) 5, 0, 2, 1.
Alternativa B.
A imagem a seguir demonstra a classificação de cada carbono.
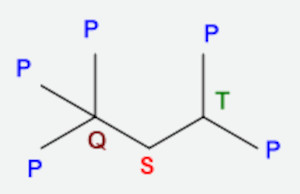
-
Questão 6
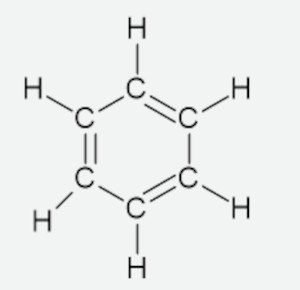
Acerca do benzeno, C6H6, é possível dizer que:
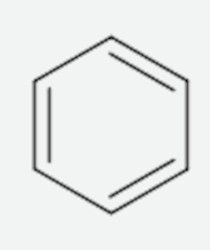
A) É uma molécula plana, visto que todos seus carbonos apresentam hibridização sp2.
B) Apresenta apenas átomos terciários.
C) Seus carbonos apresentam hibridização sp.
D) Apresenta tanto carbonos primários quanto carbonos terciários.
E) Os carbonos do benzeno são todos quirais.
Alternativa A.
Como é possível perceber, todos os átomos de carbono do benzeno realizam uma ligação dupla e duas ligações simples. Sendo assim, apresentam hibridização sp2 e, portanto, geometria trigonal plana. Por isso, é possível dizer que o benzeno é uma molécula plana.
-
Questão 7
A estrutura a seguir representa o acetaminofeno, popularmente conhecido como paracetamol.
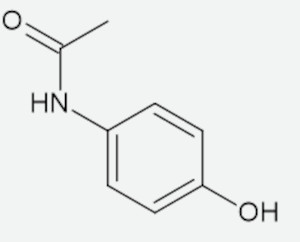
Sobre a estrutura do paracetamol, é possível dizer que:
A) Existem 3 carbonos quirais em sua estrutura.
B) Todos os carbonos presentes apresentam hibridização sp2.
C) Todos os carbonos primários apresentam hibridização sp3.
D) Estão presentes apenas carbonos primários e secundários.
E) Existe um carbono com hibridização sp.
Alternativa D.
O acetaminofeno tem na sua estrutura apenas carbonos primários e secundários, conforme mostra a imagem a seguir. Também é possível perceber a hibridização de cada carbono.
-
Questão 8
A estrutura a seguir representa a molécula do ibuprofeno, importante anti-inflamatório, indicado para diversos sintomas, como aqueles associados à dor e à febre.
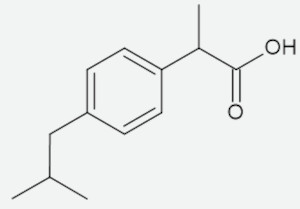
Pela análise da estrutura do ibuprofeno, o número de carbonos quirais presentes é igual a:
A) 1.
B) 2.
C) 3.
D) 4.
E) 5.
Alternativa A.
O único carbono quiral do ibuprofeno está destacado na imagem a seguir.
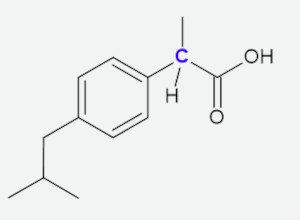
-
Questão 9
Um carbono sp3 é caracterizado por:
A) apresentar uma ligação tripla e uma ligação simples, com geometria linear.
B) apresentar duas ligações duplas, com geometria linear.
C) apresentar apenas ligações simples, com geometria tetraédrica.
D) apresentar uma ligação dupla e duas ligações simples, com geometria trigonal plana.
E) apresentar duas ligações duplas e duas ligações simples, com geometria quadrado planar.
Alternativa C.
Os carbonos de hibridização sp3 são aqueles que têm apenas ligações simples e, dessa forma, apresentam geometria tetraédrica.
Já o carbono sp pode ser aquele que tem uma ligação tripla e uma ligação simples, ou duas ligações duplas, ambas com geometria linear.
O carbono sp2, por sua vez, apresenta uma ligação dupla e duas ligações simples, com geometria trigonal plana.
-
Questão 10
Para um carbono ser considerado terciário, ele deve:
A) estar ligado a um único átomo de carbono.
B) apresentar geometria linear.
C) apresentar, obrigatoriamente, hibridização sp2.
D) estar sempre ligado apenas a átomos de carbono.
E) se ligar a três átomos de carbono.
Alternativa E.
Os carbonos terciários são aqueles que se ligam a três átomos de carbono. Para que isso seja possível, tal carbono deve ser do tipo sp2 ou sp3 para que possa ter, pelo menos, três ligações disponíveis para realizar com outros átomos de carbono.
-
Questão 11
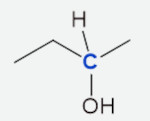
Com base nos álcoois representados a seguir, identifique a estrutura que tenha um carbono quiral.
A)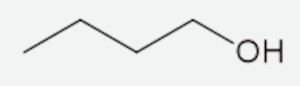
B)
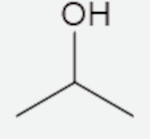
C)
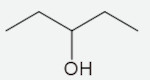
D)
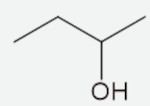
E)
-
Questão 12
A estrutura a seguir é conhecida como citronelal, bastante presente em óleos essenciais e com odor de rosas.
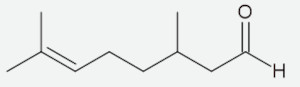
Acerca da estrutura do citronelal, é possível dizer que:
A) apresenta dois carbonos quirais.
B) apresenta três carbonos primários.
C) apresenta dois carbonos quaternários.
D) apresenta um carbono sp2.
E) apresenta quatro carbonos secundários.
Alternativa E.
Os quatro carbonos secundários da estrutura do citronelal estão indicados a seguir.