Exercícios sobre Classificação das Bases
A classificação das bases pode ocorrer segundo três critérios: o número de hidroxilas, a solubilidade e a força ou dissociação iônica.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Escreva as fórmulas das bases apresentadas abaixo e, em seguida, indique a solubilidade e a força de cada uma:
a) Hidróxido de lítio;
b) Hidróxido de potássio;
c) Hidróxido de cálcio;
d) Hidróxido de bário;
e) Hidróxido de ferro III;
f) Hidróxido de ferro II;
g) Hidróxido cuproso ou cobre I;
h) Hidróxido cúprico ou cobre II;
i) Hidróxido de amônia.
a) Hidróxido de lítio: LiOH = solúvel, forte;
b) Hidróxido de potássio: KOH = solúvel, forte;
c) Hidróxido de cálcio: Ca(OH)2 = pouco solúvel, forte;
d) Hidróxido de bário: Ba(OH)2 = pouco solúvel, forte;
e) Hidróxido de ferro III: Fe(OH)3 = insolúvel, fraca;
f) Hidróxido de ferro II: Fe(OH)2 = insolúvel, fraca;
g) Hidróxido cuproso ou cobre I: CuOH = = insolúvel, fraca;
h) Hidróxido cúprico ou cobre II: Cu(OH)2 = insolúvel, fraca;
i) Hidróxido de amônia: NH4OH = solúvel, fraca.
-
Questão 2
Dê os nomes das bases abaixo e classifique-as segundo os seguintes critérios: número de hidroxilas, força e solubilidade.
a) KOH
b) Zn(OH)2
c) Mg(OH)2
d) Ni(OH)3
e) Ca(OH)2
f) LiOH
g) Pb(OH)4
a) KOH = hidróxido de potássio.
-Número de hidroxilas: monobase;
-Força: forte;
-Solubilidade: solúvel.
b) Zn(OH)2 = hidróxido de zinco.
-Número de hidroxilas: dibase;
-Força: fraca;
-Solubilidade: praticamente insolúvel.
c) Mg(OH)2 = hidróxido de magnésio.
-Número de hidroxilas: dibase;
-Força: fraca;
-Solubilidade: praticamente insolúvel.
d) Ni(OH)3= hidróxido de níquel III ou hidróxido niquélico.
-Número de hidroxilas: tribase;
-Força: fraca;
-Solubilidade: praticamente insolúvel.
e) Ca(OH)2 = hidróxido de cálcio.
-Número de hidroxilas: dibase;
-Força: forte;
-Solubilidade: parcialmente insolúvel.
f) LiOH = hidróxido de lítio.
-Número de hidroxilas: monobase;
-Força: forte;
-Solubilidade: solúvel.
g) Pb(OH)4 =hidróxido de chumbo IV ou hidróxido plúmbico.
-Número de hidroxilas: tetrabase;
-Força: fraca;
-Solubilidade: praticamente insolúvel.
-
Questão 3
(Mack-SP) A tabela a seguir fornece a força e a solubilidade de bases em água:
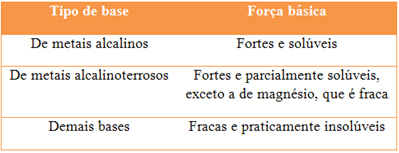
Para desentupir um cano de cozinha e para combater a acidez estomacal, necessita-se, respectivamente, de uma base forte e solúvel e de uma base fraca e parcialmente solúvel.
Consultando a tabela acima, conclui-se que as fórmulas dessas bases podem ser:
a) Ba(OH)2 e Fe(OH)3
b) Al(OH)3 e NaOH
c) KOH e Ba(OH)2
d) Cu(OH)2 e Mg(OH)2
e) NaOH e Mg(OH)2
Alternativa “e”. O hidróxido de sódio é uma base forte utilizada no desentupimento de canos. O hidróxido de magnésio é uma base fraca utilizada para combater a acidez estomacal, da mesma forma que o hidróxido de alumínio.
-
Questão 4
(Osec-SP) Uma base forte deve ter ligado ao grupo OH-:
a) Um elemento muito eletropositivo.
b) Um elemento muito eletronegativo.
c) Um semimetal.
d) Um metal que dê três elétrons.
e) Um ametal.
Alternativa “a”. As bases mais fortes são principalmente as que contêm metais alcalinos, pois os elementos desse grupo são muito eletropositivos. Por serem muito eletropositivos, esses elementos têm a tendência de ficar em solução na forma catiônica ( Na+, K+, etc. ) e, com isso, liberam OH- muito facilmente, o que configura uma base forte.