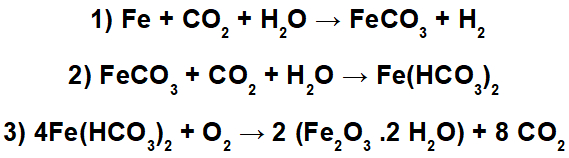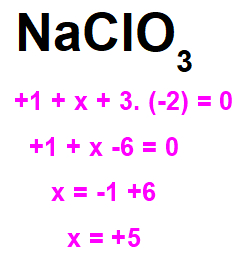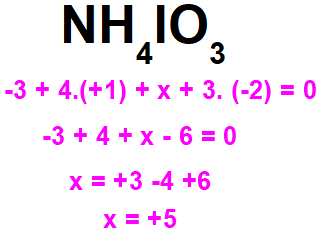Exercícios sobre conceito de número de oxidação
Estes exercícios sobre conceito de número de oxidação exploram regras fundamentais para determinação do NOX de um elemento em substâncias simples ou compostas.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Quando há diminuição do pH, a ferragem fica desprotegida. No processo de oxidação do ferro, ocorrem expansão de volume e, consequente, fragmentação do concreto. As equações que podem representar a formação da ferrugem pela ação do CO e da água são:
Os números de oxidação do ferro nos compostos Fe(HCO3)2 e Fe2O3.2H2O são, respectivamente:
a) +1 e +2
b) +1 e +3
c) +2 e +2
d) +2 e +3
e) +3 e +3
Letra d)
Para determinar o NOX do ferro nas substâncias fornecidas, basta utilizarmos o raciocínio paraconstrução da fórmula de um composto iônico. Vale ressaltar que, durante a montagem da fórmula, a carga do íon transforma-se na quantidade de átomos do outro grupo. Assim:
-
Fe(HCO3)2 = os índices 1 no ferro e 2 no bicarbonato indicam as quantidades de elementos. Por ser um composto iônico, as quantidades resultam no cruzamento de cargas. Dessa forma, podemos afirmar que o NOX do ferro é +2, enquanto que o NOX do bicarbonato é -1.
-
Fe2O3.2H2O = os índices 2 no ferro e 3 no óxido indicam as quantidades de elementos. Por ser um composto iônico, as quantidades resultam no cruzamento de cargas. Dessa forma, podemos afirmar que o NOX do ferro é +3, enquanto que o NOX do oxigênio é -2.
-
-
Questão 2
Dadas as alternativas, assinale aquela cujo óxido encontrado na natureza tem metal com número de oxidação +3.
a) Cu2O
b) Cr2O3
c) PbO
d) Na2O
e) CaO
Letra b)
Todas as alternativas apresentam um óxido, substância cujo oxigênio tem NOX -2. Assim, para determinar o NOX de cada metal, basta lembrar que, em uma substância composta, a soma dos NOX é sempre igual a 0.
a- Como o NOX do oxigênio é sempre igual a -2 nos óxidos e a somatória deve resultar 0, Cu deve apresentar um NOX igual a +1.
b- Como o NOX do oxigênio é sempre igual a -2 nos óxidos e a somatória deve resultar 0, Cr deve apresentar um NOX igual a +3.
c- Como o NOX do oxigênio é sempre igual a -2 nos óxidos e a somatória deve resultar 0, Pb deve apresentar um NOX igual a +2.
d-Como o NOX do oxigênio é sempre igual a -2 nos óxidos e a somatória deve resultar 0, Na deve apresentar um NOX igual a +1.
e- Como o NOX do oxigênio é sempre igual a -2 nos óxidos e a somatória deve resultar 0, Ca deve apresentar um NOX igual a +2.
-
Questão 3
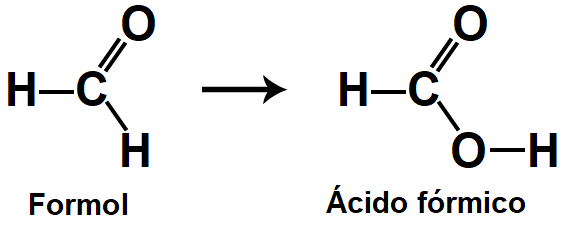
(UERJ) O formol ou formalina é uma solução aquosa de metanal utilizada na conservação dos tecidos de animais e de cadáveres humanos para estudos em Biologia e Medicina. Ele é oxidado a ácido fórmico segundo a equação a seguir a fim evitar que os tecidos animais sofram deterioração ou oxidação.
Nessa transformação, o número de oxidação do carbono sofreu uma variação de:
a) - 4 para + 4
b) - 3 para - 2
c) - 2 para - 1
d) 0 para + 2
Letra d)
-
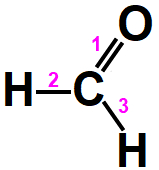
No formol, o oxigênio tem NOX -2 por atrai um elétron do carbono em cada ligação da dupla (ligação 1). Assim, o carbono tem NOX +2. No entanto, o carbono está atraindo um elétron de cada ligação simples (ligações 2 e 3) realizada com os hidrogênios, o que o deixaria com NOX -2. Como o carbono apresenta perda e ganho de 2 elétrons, seu NOX real é 0.
-
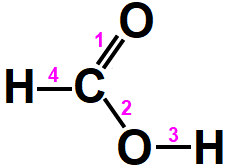
No ácido fórmico, o oxigênio tem NOX -2 por atrair um elétron do carbono em cada ligação da dupla (ligação 1). Assim o carbono tem NOX +2. O outro oxigênio tem NOX -2 por atrai um elétron do carbono (ligação 2) e outro elétron do hidrogênio (ligação 3) em cada uma das ligações simples realizadas. Assim, o carbono fica com NOX +1. Por fim, o carbono atrai um elétron na ligação simples com o hidrogênio (ligação 4), ficando com NOX -1. Como o carbono apresenta perda de 3 elétrons (resultante dos NOX +2 e +1) e ganho de um elétron (representado pelo NOX -1), seu NOX real é +2.
-
-
Questão 4
(Cesgranrio) Os números de oxidação dos halogêneos nos compostos NaCl, NaClO3, KI, I2, NH4IO3 são, respectivamente:
a) +1, +3, 0, -2, +4
b) +1, -5, -1, 0, +5
c) -1, -5, +1, 0, -5
d) -1, +5, -1, 0, +5
e) -1, -3, +1, 0, -4
Letra d)
-
NaCl: por ser uma substância composta, a soma dos números de oxidação do Na e do Cl deve ser igual a 0. Como o NOX do Na é fixo e igual +1, o Cl deve apresentar um NOX igual a -1.
-
NaClO3: por ser uma substância composta, a soma dos números de oxidação do Na, Cl e O deve ser igual a 0. Como o NOX do Na é fixo e igual a +1 e o NOX do oxigênio em sais é fixo e igual -2, o Cl deve apresentar um NOX igual a +5.
-
Kl: por ser uma substância composta, a soma dos números de oxidação do K e do l deve ser igual a 0. Como o NOX do K é fixo e igual +1, o l deve apresentar um NOX igual a -1.
-
l2: por ser uma substância simples, o NOX é sempre igual a 0.
-
NH4IO3: por ser uma substância composta, a soma dos números de oxidação do N, H, l e O deve ser igual a 0. Como o NOX do nitrogênio (quando associado ao hidrogênio) é fixo e igual a -3, o NOX do H (quando está com ametais) é fixo e igual a +1 e o NOX do oxigênio em sais é fixo e igual a -2, o l deve apresentar um NOX igual a +5.
-