Exercícios sobre concentração dos reagentes e velocidade das reações
(Fuvest-SP) Em solução aquosa ocorre a transformação:
H2O2 + 2 I- + 2 H+ → 2 H2O + I2
(Reagentes) (Produtos)
Em quatro experimentos, mediu-se o tempo decorrido para a formação de mesma concentração de I2, tendo-se na mistura de reação as seguintes concentrações iniciais de reagentes:
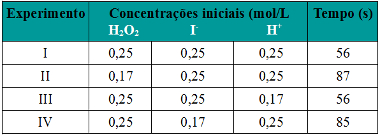
Tabela de exercício sobre concentração dos reagentes e velocidade das reações
Esses dados indicam que a velocidade da reação considerada depende apenas da concentração de:
a) H2O2 e I−.
b) H2O2 e H+.
c) H2O2.
d) H+.
e) I−.
Alternativa “a”.
Quando se diminuiu a concentração do H2O2 e do I− nos experimentos II e IV, respectivamente, a velocidade da reação diminuiu e o tempo foi maior. Mas quando se diminuiu a concentração do H+, no experimento III, a velocidade da reação não foi alterada.
(UEPG-PR) Aparas de magnésio foram colocadas para reagir com ácido clorídrico em diferentes concentrações. Em todas as amostras, observou-se que, após determinado tempo, ocorreu a dissolução do metal, com a evolução de gás hidrogênio. A respeito dessa experiência, considerando os dados apresentados na tabela abaixo, assinale o que for correto.
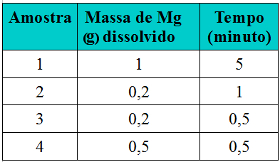
Exercício sobre inlfuência da concentração dos reagentes sobre a velocidade das reações
(01) Comparativamente, a reação da amostra 4 apresentou a maior velocidade média.
(02) Comparativamente, a amostra 1 liberou a maior quantidade de gás hidrogênio por causa da maior quantidade de magnésio dissolvido.
(04) Apesar de ter sido utilizada a mesma massa de Mg nas amostras 2 e 3, observa-se que o tempo de sua dissolução na amostra 2 foi maior, o que pode ser resultado da utilização de uma menor concentração de ácido clorídrico nessa amostra.
(08) Se nessa experiência tivesse sido utilizado magnésio em pó, a velocidade de todas as reações teria sido maior, por causa do aumento da superfície de contato entre os reagentes.
Soma: 1 + 2 + 4 + 8 = 15. Todas as alternativas estão corretas.
A queima de combustíveis fósseis que contêm enxofre polui a atmosfera com dióxido de enxofre [SO2(g)], o qual pode oxidar-se e reagir com a água, formando chuva ácida [H2SO4(aq)]. O carbonato de cálcio (CaCO3), substância presente no mármore, reage com a chuva ácida segundo a reação:
CaCO3(s) + H2SO4(aq)→ CaSO4(s) + H2O(l) + CO2(g)
Esse fenômeno é responsável pela transformação do mármore de estátuas em gesso (material que contém sulfato de cálcio).
Qual dos fatores abaixo deve fazer com que essa reação seja mais rápida?
a) Condições atmosféricas com pH mais elevado.
b) Temperaturas baixas.
c) Condições atmosféricas com pH mais baixo.
d) Baixa pressão atmosférica.
Alternativa “c”.
Com as condições atmosféricas com pH mais baixo, a concentração do ácido aumentará e a velocidade da reação também aumentará.
Qual das situações a seguir favorece a combustão do carbono presente no carvão, aumentando a velocidade dessa reação?
a) Usar um pedaço de carvão bem grande.
b) O comburente ser o ar atmosférico.
c) Abaixar a temperatura da vizinhança.
d) Usar como comburente oxigênio puro.
Alternativa “d”.
Os reagentes dessa reação de combustão são o carvão (carbono) e o oxigênio. Se o comburente for oxigênio puro no lugar do ar atmosférico, a concentração do reagente oxigênio aumentará, o que aumentará a incidência de choques efetivos entre suas partículas e aumentará a velocidade da reação.






