Exercícios sobre densidade
Teste seus conhecimentos por meio desta lista de exercícios sobre densidade, uma das propriedades da matéria.
Publicado por: Stéfano Araújo NovaisQuestões
-
Questão 1
(Enem)
O consumo exagerado de refrigerantes é preocupante, pois contribui para o aumento de casos de obesidade e diabetes. Considere dois refrigerantes enlatados, um comum e um diet, e que ambos possuem a mesma quantidade de aditivos, exceto pela presença de açúcar. O refrigerante comum contém basicamente água carbonatada e grande quantidade de açúcar; já o refrigerante diet tem água carbonatada e adoçantes, cujas massas são muito pequenas.
CAVAGIS A D M. PEREIRA E. A. OLIVEIRA, L. C. Um método simples para avaliar o teor de sacarose e CO, em refrigerantes. Quimica Nova na Escola, n. 3. ago. 2014 (adaptado).
Entre as duas versões apresentadas, o refrigerante comum possui:
A) maior densidade.
B) menor viscosidade.
C) maior volume de gás dissolvido.
D) menor massa de solutos dissolvidos.
E) maior temperatura de congelamento.
Alternativa A.
O refrigerante comum difere da versão diet apenas na questão do açúcar. Como o açúcar tem maior massa que o adoçante utilizado, é possível dizer que a massa contida em uma lata de 350 mL de refrigerante comum é maior que a massa contida em uma lata de 350 mL de refrigerante diet. Assim sendo, como o refrigerante comum concentra uma maior massa em um mesmo volume, ele possui uma densidade maior que o refrigerante diet.
-
Questão 2
(Enem PPL) A densidade é uma propriedade que relaciona massa e volume de um material. Um estudante iniciou um procedimento de determinação da densidade de uma amostra sólida desconhecida. Primeiro ele determinou a massa da amostra, obtendo 27,8 g. Em seguida, utilizou uma proveta, graduada em mililtro, com água para determinar o volume da amostra, conforme esquematizado na figura. Considere a densidade da água igual a 1 g/mL.
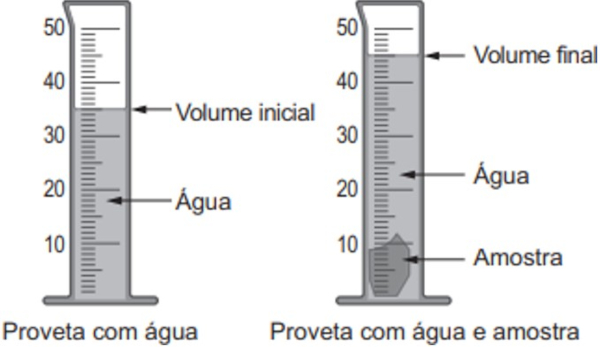
A densidade da amostra obtida, em g/mL, é mais próxima de
A) 0,36.
B) 0,56.
C) 0,62.
D) 0,79.
E) 2,78.
Alternativa E.
Pela imagem, percebe-se que o volume variou de 45 mL para 55 mL. Portanto, a amostra possui 10 mL de volume. Como sua massa é de 27,8 gramas, é possível dizer que sua densidade é:
d = 27,8 g / 10 mL
d = 2,78 g/mL
-
Questão 3
(Enem) As moedas despertam o interesse de colecionadores, numismatas e investidores há bastante tempo. Uma moeda de 100% cobre, circulante no período do Brasil Colônia, pode ser bastante valiosa. O elevado valor gera a necessidade de realização de testes que validem a procedência da moeda, bem como a veracidade de sua composição. Sabendo que a densidade do cobre metálico é de 9 g ∙ cm−3, um investidor negocia a aquisição de um lote de quatro moedas A, B, C e D fabricadas supostamente de 100% cobre e massas 26 g, 27 g, 10g e 36 g, respectivamente. Com o objetivo de testar a densidade das moedas, foi realizado um procedimento em que elas foram sequencialmente inseridas em uma proveta contendo 5 mL de água, conforme esquematizado.
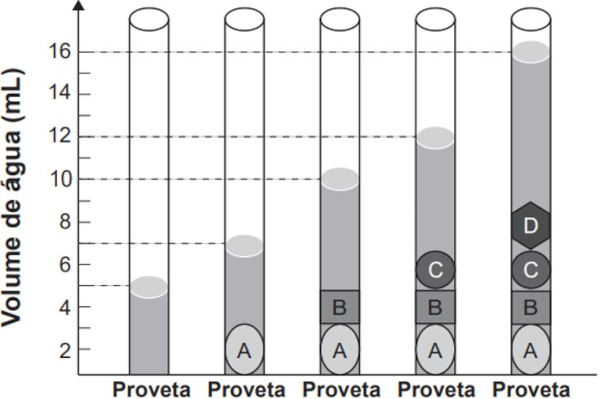
Com base nos dados obtidos, o investidor adquiriu as moedas
A) A e B.
B) A e C.
C) B e C.
D) B e D.
E) C e D.
Alternativa D.
O volume de cada moeda pode ser determinado de acordo com a variação observada na proveta.
- Moeda A: volume de 2 mL (variou de 5 mL para 7 mL). A densidade será igual a 26 g/2 mL, cujo valor é de 13 g/mL. Logo, a moeda A não é de cobre.
- Moeda B: volume de 3 mL (variou de 7 mL para 10 mL). A densidade será igual a 27 g/3 mL, cujo valor é de 9 g/mL. Logo, a moeda B é de cobre.
- Moeda C: volume de 2 mL (variou de 10 mL para 12 mL). A densidade será igual a 10 g/2 mL, cujo valor é de 5 g/mL. Logo, a moeda C não é de cobre.
- Moeda D: volume de 4 mL (variou de 12 mL para 16 mL). A densidade será igual a 36 g/4 mL, cujo valor é de 9 g/mL. Logo, a moeda D é de cobre.
-
Questão 4
(Enem PPL) Um laudo de análise de laboratório apontou que amostras de leite de uma usina de beneficiamento estavam em desacordo com os padrões estabelecidos pela legislação. Foi observado que a concentração de sacarose era maior do que a permitida.
Qual teste listado permite detectar a irregularidade descrita?
A) Medida da turbidez.
B) Determinação da cor.
C) Determinação do pH.
D) Medida da densidade.
E) Medida da condutividade.
Alternativa D.
A densidade é sensível à alteração de composição química. A presença ou ausência de sacarose irá influenciar no valor final da densidade e, portanto, esse pode ser um teste para detectar a irregularidade do leite.
A sacarose não altera a turbidez do leite, pois se dissolve completamente nele, assim como não altera sua cor. A sacarose não tem influência no pH do leite e, por ser uma substância que não se ioniza em solução, não altera a condutividade do leite também.
-
Questão 5
Considere três líquidos imiscíveis: um com densidade 1,5 g/mL, outro com a densidade igual a 0,6 g/mL e um terceiro com densidade igual a 2,3 g/mL. Todos foram colocados em um recipiente, conforme a imagem a seguir demonstra.
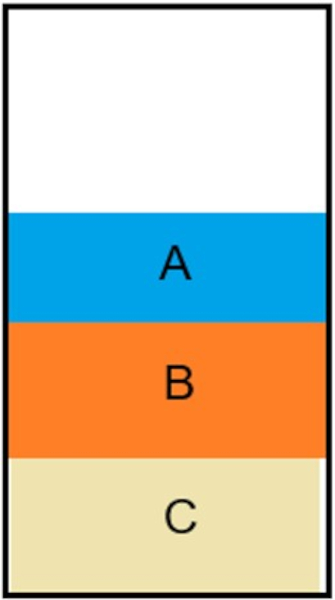
De acordo com as densidades dos líquidos, podemos afirmar que as densidades das frações A, B e C são, respectivamente:
A) 1,5 g/mL; 2,3 g/mL; 0,6 g/mL.
B) 0,6 g/mL; 1,5 g/mL; 2,3 g/mL.
C) 2,3 g/mL; 1,5 g/mL; 0,6 g/mL.
D) 2,3 g/mL; 0,6 g/mL; 1,5 g/mL.
E) 0,6 g/mL; 2,3 g/mL; 1,5 g/mL.
Alternativa B.
A posição das frações é determinada pela densidade. Quanto mais denso for o líquido, mais ao fundo ele fica. Dessa forma, a fração A é a menos densa, seguida por B e, por fim, C.
-
Questão 6
Uma amostra metálica possui massa igual a 13,5 gramas. Seu volume foi determinado em 5 mL. A densidade da amostra metálica, em g/mL, é igual a:
A) 5 g/mL.
B) 13,5 g/mL.
C) 2,7 g/mL.
D) 18,5 g/mL.
E) 0,37 g/mL.
Alternativa C.
A densidade é calculada como?
d = massa/volume
d = 13,5 g/5 mL
d = 2,7 g/mL
-
Questão 7
Um experimento foi realizado em um laboratório químico com o fim de identificar duas substâncias sólidas (sólido A e sólido B) e uma substância líquida (líquido C) por meio de suas densidades, em comparação à água.
A densidade da água é igual a 1 g/mL, enquanto as substâncias A, B e C podem ter uma das seguintes densidades: 0,9 g/mL, 2,7 g/mL e 13 g/mL.
Ao se realizar o experimento, observou-se que:
- O sólido A flutuou na água.
- O sólido B afundou na água.
- O líquido C formou uma fase abaixo da água.
- O sólido A flutuou no líquido C.
- O sólido B flutuou no líquido C.
Com base nas informações do experimento, é possível determinar que as densidades das substâncias A, B e C são, respectivamente:
A) 0,9 g/mL, 2,7 g/mL e 13 g/mL.
B) 2,7 g/mL, 13 g/mL e 0,9 g/mL.
C) 0,9 g/mL, 13 g/mL e 2,7 g/mL.
D) 13 g/mL, 2,7 g/mL e 0,9 g/mL.
E) 2,7 g/mL, 0,9 g/mL e 13 g/mL.
Alternativa E.
O sólido B flutua não só no líquido C, como também na água; logo, é o que possui menor densidade (0,9 g/mL).
O sólido A afunda na água, mas flutua no líquido C, então possui uma densidade maior que da água, porém menor que do líquido C. Por isso, o sólido A possui densidade de 2,7 g/mL e o líquido C possui uma densidade de 13 g/mL.
-
Questão 8
Três recipientes (1, 2 e 3) possuem volumes diferentes de três líquidos distintos.
- O líquido do recipiente 1 possui 150 g de massa e 140 mL de volume.
- O líquido do recipiente 2 possui 400 g de massa e 480 mL de volume.
- O líquido do recipiente 3 possui 300 g de massa e 240 mL de volume.
A ordenação da densidade dos três líquidos, em ordem decrescente, é:
A) d1 > d2 > d3
B) d3 > d2 > d1
C) d1 > d3 > d2
D) d2 > d3 > d1
E) d3 > d1 > d2
Alternativa E.
A densidade de cada recipiente é calculada pela fórmula d = massa/volume. Assim:
d1 = 150 / 140 = 1,07 g/mL
d2 = 400 / 480 = 0,83 g/mL
d3 = 300 / 240 = 1,25 g/mL
Em ordem decrescente: d3 > d1 > d2.
-
Questão 9
A tabela apresenta a densidade de cinco substâncias líquidas distintas, todas medidas a 20 °C.
Substância líquida
Densidade (g/mL)
Ácido etanóico
1,05
Água
1,00
Etanol
0,79
Benzeno
0,88
Hexano
0,66
Considere que uma amostra líquida contenha 8,08 g de massa e um volume igual a 7,68 mL.
De acordo com os dados da tabela, a substância líquida é:
A) ácido etanoico.
B) água.
C) etanol.
D) benzeno.
E) hexano.
Alternativa A.
O cálculo da densidade servirá para identificar a substância em questão:
d = 8,08 g / 7,68 mL
d = 1,05 g/mL
Trata-se, então, do ácido etanoico.
-
Questão 10
Uma unidade de reciclagem recebeu uma peça metálica, cuja composição química não era conhecida. Por isso, decidiram retirar um pequeno pedaço da peça e fazer a determinação da sua densidade, para que pudesse ser feita a devida identificação. Colocaram 100 mL água, cuja densidade é de 1 g/mL, sob uma balança. A balança foi tarada de modo que fosse aferida apenas a massa de água colocada.
Posteriormente, inseriram o pequeno pedaço da peça metálica dentro desse recipiente com água e perceberam que o volume final marcado no recipiente era de 150 mL, enquanto a massa na balança era de 136,5 gramas.
Os metais mais comuns que essa unidade de reciclagem recebe são prata (d = 10,5 g/mL), alumínio (d = 2,7 g/mL), cobre (d = 8,9 g/mL), estanho (d = 7,3 g/mL) e ferro (d = 7,9 g/mL).
Com base nas densidades dos metais mais comuns presentes na unidade reciclagem, é possível determinar que a peça metálica é composta de:
A) prata.
B) alumínio.
C) cobre.
D) estanho.
E) ferro.
Alternativa C.
A balança, como foi tarada apenas para medir a massa de água, marcava, inicialmente, 100 gramas, pois a densidade da água é de 1 g/mL, o que quer dizer que um volume de 100 mL possui 100 gramas de massa.
Ao se inserir a amostra, percebeu-se que o volume variou de 50 mL, enquanto a massa acresceu de 36,5 g. Com isso, calcula-se a densidade da amostra metálica:
d = 36,5 g / 50 mL
d = 7,3 g/mL
Assim, conclui-se que a amostra metálica é feita de estanho.
-
Questão 11
Para a determinação de três embalagens plásticas distintas, um químico se utilizou de duas soluções: uma de água pura, com densidade igual a 1,00 g/mL, e outra de água salgada, com densidade igual a 1,18 g/mL.
A tabela a seguir apresenta as densidades de três plásticos que o químico suspeita que sejam os constituintes das embalagens analisadas.
Plástico
Densidade (g/mL)
Polipropileno (PP)
0,90
Poliestireno (PS)
1,05
Poliuretano (PU)
1,25
A primeira embalagem flutuou tanto na água pura quanto na água salgada. Já a segunda embalagem afundou em ambas. A terceira embalagem afundou na água pura, mas flutuou na água salgada.
Com base nos resultados obtidos, é possível afirmar que:
A) a primeira embalagem é composta de poliuretano.
B) o poliestireno flutua tanto na água salgada, quanto na água pura.
C) a terceira embalagem é feita de poliestireno, enquanto a primeira embalagem é feita de polipropileno.
D) o poliuretano está na composição da embalagem que flutua tanto na água pura quanto na água salgada.
E) o polipropileno é o plástico constituinte da terceira embalagem.
Alternativa C.
A primeira embalagem é feita de polipropileno, pois, ao flutuar na água pura e na água salgada, demonstra uma densidade menor que 1,0 g/mL. Já a segunda embalagem é feita de poliuretano, pois, ao afundar na água pura e na água salgada, demonstrou possuir uma densidade maior que 1,18 g/mL. Já a terceira embalagem, ao afundar na água pura e flutuar na água salgada, demonstrou ter uma densidade entre 1,0 g/mL e 1,18 g/mL, sendo então constituída de poliestireno.
-
Questão 12
Ao colocar um ovo em um recipiente contendo água pura, percebe-se que ele afunda no recipiente. Porém, ao se dissolver, gradativamente, uma boa quantidade de sal, o ovo passa a flutuar. Dessa forma, tal fenômeno pode ser explicado da seguinte forma:
A) A densidade do ovo diminuiu durante o experimento.
B) A mistura de água e sal é menos densa que o ovo.
C) A densidade da água salgada é maior que da água pura.
D) Percebeu-se uma diminuição da massa do ovo.
E) Houve uma alteração significativa no pH da solução.
Alternativa C.
O ovo é mais denso que a água pura, pois ele afunda nesse sistema. Quando a salinidade aumenta, o ovo passa a flutuar, indicando que a densidade da água salgada é maior que a do ovo; logo, a densidade da água salgada é maior que da água pura.