Exercícios sobre efeito do íon comum
Estes exercícios sobre o efeito do íon comum testarão seus conhecimentos sobre a influência em um equilíbrio químico da adição de um íon já existente no sistema.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
(UERJ) A água sanitária é um agente desinfetante que contém a substância hipoclorito de sódio. A equação química a seguir representa o equilíbrio do íon hipoclorito com o ácido hipocloroso, um agente desinfetante ainda mais eficiente.
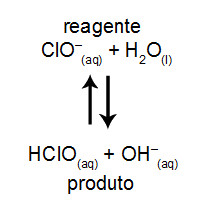
Em um processo de limpeza, quantidades iguais de água sanitária foram adicionadas a volumes iguais de líquidos com diferentes valores de pH a 25 ºC, de acordo com a tabela.
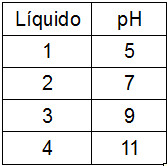
O líquido no qual a água sanitária apresenta maior ação desinfetante é o de número:
a) 1
b) 2
c) 3
d) 4
Letra a). De acordo com o enunciado, o ácido hipocloroso (HClO) é o responsável pela ação desinfetante, por isso, é importante que esse equilíbrio seja deslocado para o sentido de aumentar a concentração do ácido, ou seja, para a direita. O líquido da solução de número 1 apresenta um pH menor que 7, logo, possui uma maior concentração de íons H+, os quais interagem com os íons OH- do equilíbrio, deslocando-o para a direita.
As outras soluções apresentam uma maior concentração de OH-, o que desloca o equilíbrio para a esquerda.
-
Questão 2
(UFC) A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas rosa e azul dos íons cobalto.
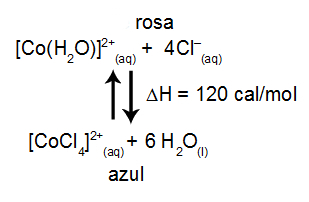
Assinale a alternativa que apresenta uma ação sobre o sistema que favorece a formação da solução de cor azul.
a) Diminuição da concentração de Cl–.
b) Diminuição da temperatura.
c) Diluição da solução.
d) Aumento da concentração de água.
e) Adição de cloreto de sódio aquoso.
Letra e). A solução aquosa de cloreto de sódio possui íons sódio (Na+) e cloreto (Cl-), sendo o cloreto um íon comum ao equilíbrio. Assim, a adição dessa solução aumenta a concentração dos íons cloreto, o que, segundo o principio de Le Chatelier, desloca o equilíbrio para o lado oposto ao do íon que está sendo adicionado, ou seja, para o lado direito (azul). Já as outras alternativas estão incorretas porque:
a) Desloca o equilíbrio no sentido da diminuição, ou seja, para a esquerda.
b) Como o exercício não informou a variação de entalpia do processo, é difícil avaliar o efeito da temperatura.
c/d) Ambas tratam do aumento da concentração de água, o que não alteraria o equilíbrio porque ela está relacionada com todos os componentes.
-
Questão 3
Um exemplo de ácido fraco é o ácido oxálico (H2C2O4) cuja equação de ionização está representada pelo equilíbrio a seguir:
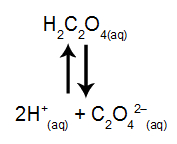
Analisando o equilíbrio acima, qual entre as substâncias propostas a seguir seria capaz de deslocar esse equilíbrio no sentido de favorecer a ionização do ácido?
a) NH4Br.
b) HBr.
c) NaI.
d) K2CO3.
e) H2O.
Letra d). O sal K2CO3 apresenta íon carbonato (CO3-2), o qual, em contato, com o íon H+ interage porque forma um ácido fraco, o ácido carbônico (H2CO3). Dessa forma, a concentração de íons H+ do meio seria reduzida, deslocando o equilíbrio para a direita, o sentido da ionização do ácido.
-
Questão 4
A equação a seguir representa o equilíbrio de dissolução do dióxido de carbono (CO2) em água:
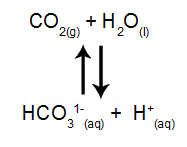
Quando um rio está localizado em uma região de elevada altitude, apresentando, portanto, uma menor quantidade de CO2(g), qual dos eventos a seguir ocorre com o equilíbrio iônico da dissolução proposto acima?
a) diminui a concentração de hidrônios [H1+].
b) diminui a concentração de hidróxidos [OH1-].
c) aumenta a concentração do íon bicarbonato [HCO31-].
d) não altera o pH.
e) aumenta a quantidade de CO2(g) dissolvido na água.
Letra a). Em uma região de elevada altitude, temos menor quantidade de CO2 no ar, logo, o equilíbrio é deslocado no sentido do CO2 (princípio de Le Chatelier). Por isso, ocorrerá uma diminuição das concentrações dos íons HCO31- e H1+ e um aumento da concentração de íons OH- e do pH, em virtude da maior presença de íons OH-.