Exercícios sobre eletroafinidade ou afinidade eletrônica
Estes exercícios sobre eletroafinidade exigem conhecimentos sobre as características dessa importante propriedade periódica dos elementos químicos.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
(UFPB) Considerando a formação do cloreto de sódio representada abaixo:
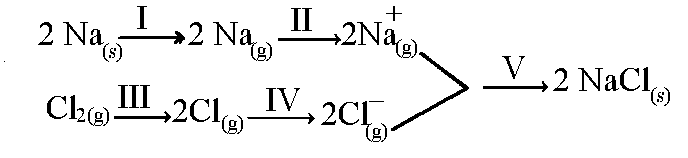
As etapas referentes à energia e à afinidade eletrônica são, respectivamente,
a) II e I
b) III e V
c) IV e III
d) II e IV
e) V e I
Letra d). Apenas as etapas II e IV envolvem a formação de íons. Na etapa II, há perda de elétron (energia); e na IV, ganho de elétron (afinidade).
-
Questão 2
(ITA-SP) Dadas as configurações eletrônicas dos seguintes átomos no seu estado fundamental.
I. 1s2 2s2 2p63s2 3p6
II. 1s2 2s2 2p63s2
III. 1s2 2s2 2p6 3s2 3p6 4s1
IV. 1s2 2s2 2p63s2 3p5.
É ERRADO afirmar que:
a) Dentre os átomos acima, o átomo I tem o maior potencial de ionização.
b) A perda de dois elétrons pelo átomo II leva à formação do cátion Mg2+.
c) Dentre os átomos acima, o átomo III tem a maior afinidade eletrônica.
d) O ganho de um elétron pelo átomo IV ocorre com a liberação de energia.
e) O átomo IV é o mais eletronegativo.
Letra c). O item III é falso porque a afinidade eletrônica desse átomo é muito pequena, pois trata-se de um metal alcalino.
-
Questão 3
(PUC-RS) Considerando a afinidade eletrônica e o potencial de ionização ao longo de um mesmo grupo da tabela periódica, de uma maneira geral, é possível afirmar que
a) diminuem com o aumento do número atômico, devido ao aumento do número de camadas.
b) aumentam com o aumento do número atômico, devido ao aumento do tamanho do átomo.
c) não sofrem variações, pois não sofrem influência da variação do número atômico.
d) não sofrem a mesma variação, pois são propriedades aperiódicas.
e) aumentam com o aumento do número atômico, devido ao aumento do número de elétrons.
Letra a). Como a afinidade eletrônica e o potencial de ionização são diretamente proporcionais, sofrem a mesma diminuição com o aumento do número atômico em um mesmo grupo. Quanto maior for o número de níveis, maior será o raio e menor será a afinidade e o potencial de ionização.
-
Questão 4
O elemento químico com maior afinidade eletrônica do 2o período da tabela periódica é o:
a) Be
b) F
c) N
d) B
e) C
Letra b). Analisando a tabela periódica, a ordem dos elementos dados no segundo período é: Be, B, C, N, F. Como a eletroafinidade cresce da esquerda para a direita, o elemento mais eletronegativo é o flúor.
-
Questão 5
Dadas as distribuições eletrônicas a seguir:
I-1s2 2s2 2p3
II- 1s2 2s2 2p6 3s2
III- 1s2 2s2 2p63s2 3p5
IV- 1s2 2s2 2p6 3s2 3p6 4s2
V- 1s2 2s2 2p6 3s2 3p6 4s2 3d9
Qual dos átomos apresenta a menor afinidade eletrônica?
a) I
b) II
c) III
d) IV
e) V
Letra d). Os elementos II, IV e V são metais, e os elementos I e III são ametais. Quando comparados com ametais, os metais (II, IV e V) apresentam menor afinidade eletrônica. Para definir quem tem menor afinidade (II, IV e V), vamos levar em consideração o fato de o IV e V terem o mesmo número de níveis (quatro níveis), porém apresentam números atômicos diferentes, consequentemente aquele que tiver o menor número atômico no mesmo nível sempre terá menor afinidade eletrônica.
-
Questão 6
(OSEC-SP) Pode-se esperar que seja formado um composto iônico quando um elemento de natureza metálica se combina com outro elemento de:
a) elevada eletropositividade;
b) baixa energia de ionização;
c) elevado número atômico;
d) natureza metálica;
e) elevada afinidade eletrônica.
Letra e). Como se trata de um composto iônico, nele um átomo tem a tendência de perder elétrons (natureza metálica) e outro tem a tendência de ganhar elétrons (elevada afinidade eletrônica ou elevada energia de ionização).
-
Questão 7
Um determinado elemento químico localizado no terceiro período da tabela periódica apresenta uma alta afinidade eletrônica quando comparado com os outros elementos desse período. Dos elementos propostos a seguir, qual deles seria esse elemento?
a) Enxofre
b) Alumínio
c) Silício
d) Cloro
e) Fósforo
Letra d). Quando comparamos a afinidade eletrônica de elementos localizados em um mesmo período, o elemento de maior número atômico sempre terá a maior afinidade eletrônica.
-
Questão 8
Dados os elementos químicos a seguir, qual alternativa apresenta os elementos químicos de menor afinidade eletrônica da tabela periódica?
a) Flúor e Oxigênio
b) Alumínio e Silício
c) Ferro e Cobalto
d) Polônio e Astato
e) Frâncio e Rádio
Letra e).