Exercícios sobre Eletrólise em Meio Aquoso
A eletrólise em meio aquoso é feita passando-se uma corrente elétrica em uma solução aquosa com íons dissolvidos, gerando reações químicas.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Considere a eletrólise do brometo de cálcio (CaBr2(aq)), feita com eletrodos inertes, em solução aquosa. Determine os cátions e os ânions, respectivamente, que se descarregam primeiro:
-
Ca2+(aq) e Br-(aq)
-
Ca2+(aq) e OH-(aq)
-
H3O+(aq) e Br-(aq)
-
H3O+(aq) e OH-(aq)
-
Ca2+(aq) e H3O+(aq)
Alternativa “c”.
Os cátions existentes no meio são o Ca2+(aq) (proveniente do brometo de cálcio) e H3O+(aq) (proveniente da água), mas segundo a ordem de facilidade de descarga dos íons em eletrólise aquosa, os cátions de metais alcalinoterrosos (que é o caso do Ca2+(aq)) não se descarregam em solução aquosa. Nesses casos, se o meio for neutro, a redução que ocorrerá no cátodo será a da água, mas se for em meio ácido, a redução será a do cátion H3O+(aq), formando o gás hidrogênio, H2.
Já os ânions existentes no meio são o Br-(aq) (proveniente do brometo de cálcio) e OH-(aq) (proveniente da água). Segundo a ordem de facilidade de descarga dos íons em eletrólise aquosa, os ânions não oxigenados (como o Br-) oxidam-se gerando no eletrodo positivo as substâncias elementares, que nesse caso é o bromo.
-
-
Questão 2
A ilustração a seguir ilustra a eletrólise de uma solução aquosa de cloreto de cobre (II).
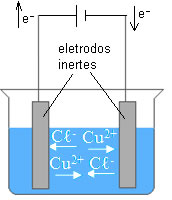
Com relação a esse processo, classifique as afirmações dos itens a seguir como verdadeiras ou falsas.
-
Os íons Cu2+ movimentam-se em direção ao ânodo, polo negativo, no qual sofrem redução.
-
A semirreação que ocorre no cátodo é: Cu2+(aq) + 2 e- → Cu(s).
-
A produção de gás cloro ocorre no cátodo, polo positivo da célula.
-
A semirreação que ocorre no ânodo é: 2 Cℓ-(aq) + 2 e- → Cℓ2(g).
- Falsa. Os íons Cu2+ são atraídos pelo cátodo, polo negativo, no qual sofrem redução.
- Verdadeira.
- Falso. O gás cloro é produzido no ânodo, polo positivo da célula.
- Falso. A semirreação é: 2 Cℓ-(aq) → Cℓ2(g) + 2 e-.
-
-
Questão 3
(ITA-SP) A figura a seguir mostra o esquema da aparelhagem utilizada por um aluno para realizar a eletrólise de uma solução aquosa ácida, com eletrodos inertes. Durante a realização da eletrólise, pela secção tracejada (A----B), houve a seguinte movimentação de partículas eletricamente carregadas através da solução:
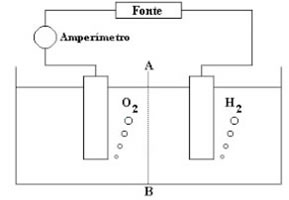
a) Elétrons da esquerda para a direita.
b) Elétrons da direita para a esquerda.
c) Cátions da esquerda para a direita e ânions da direita para a esquerda.
d) Cátions da direita para a esquerda e ânions da esquerda para a direita.
e) Cátions e ânions da esquerda para a direita.Alternativa “c”.
Se há formação de H2(g) no eletrodo da direita é porque os cátions H3O+(aq) estão descarregando nesse eletrodo. Dessa forma, os cátions caminham da esquerda para a direita em direção ao cátodo.
Se há formação de O2(g) no eletrodo da esquerda é porque os ânions OH-(aq) estão descarregando nesse eletrodo. Assim, os ânions caminham da direita para a esquerda em direção ao ânodo.
Observe que os elétrons não atravessam a secção tracejada A ---- B, pois os elétrons não atravessam a solução, eles atravessam o fio (circuito externo).
-
Questão 4
Uma solução aquosa de iodeto de potássio (KI) foi eletrolisada, usando-se a aparelhagem esquematizada na figura. Após algum tempo de eletrólise, adicionaram-se algumas gotas de solução de fenolftaleína na região do eletrodo A e algumas gotas de solução de amido na região do eletrodo B. Verificou-se o aparecimento da cor rosa na região de A e da cor azul (formação de iodo) na região de B.
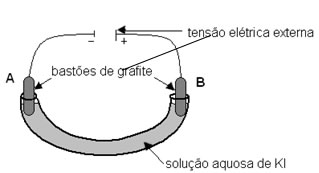
Nessa eletrólise,
- No polo negativo, ocorre redução da água com formação de OH ¯ e de H2;
- No polo positivo, o iodeto ganha elétrons e forma iodo;
- A grafite atua como condutora de elétrons.
Dessas afirmações, apenas a:
a) I é correta.
b) II é correta.
c) III é correta.
d) I e a III são corretas.
e) II e a III são corretas.
Alternativa “d”.
II- Errada. No eletrodo, polo positivo, ocorre oxidação. É onde o iodeto (I1-) perde elétrons para formar o iodo, I2.