Exercícios sobre a hibridização do carbono
Com estes exercícios sobre a hibridização do carbono, você pode testar o que sabe acerca das condições de ocorrência desse fenômeno e da identificação de estruturas químicas.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
O número de ligações químicas que um átomo é capaz de realizar está relacionado com o número de orbitais atômicos incompletos que ele apresenta em sua camada de valência. Assim sendo, qual das relações propostas a seguir não está de acordo com essa teoria?
a) Cloro, capaz de realizar uma ligação química.
b) Hidrogênio, capaz de realizar uma ligação química.
c) Carbono, capaz de realizar duas ligações químicas.
d) Nitrogênio, capaz de realizar três ligações químicas.
e) Oxigênio, capaz de realizar duas ligações químicas.
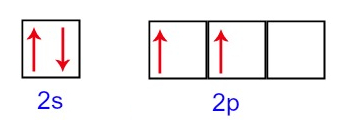
Letra c). O carbono é um elemento químico que pode realizar quatro ligações. Por sofrer hibridização, na sua camada de valência, quatro elétrons estão distribuídos nos subníveis 2s (possui um orbital) e 2p (possui três orbitais), ou seja, dois elétrons no subnível s e dois elétrons no subnível 2p. As outras alternativas estão corretas porque:
Obs.: Um orbital só pode comportar dois elétrons.
a- O cloro é um elemento que apresenta 7 elétrons distribuídos na camada de valência, mais precisamente nos subníveis 2s (possui 1 orbital) e 2p (possui 3 orbitais), ou seja, 2 elétrons no subnível s e 5 elétrons no subnível 2p. Dessa forma, esse elemento possui um orbital incompleto.
b- O hidrogênio apresenta 1 elétron na camada de valência, no subnível 2s (possui 1 orbital), ou seja, possui um orbital incompleto.
d- O nitrogênio é um elemento que apresenta 5 elétrons distribuídos na camada de valência, mais precisamente nos subníveis 2s (possui 1 orbital) e 2p (possui 3 orbitais), ou seja, 2 elétrons no subnível s e 3 elétrons no subnível 2p. Dessa forma, esse elemento possui três orbitais incompletos.
e- O oxigênio é um elemento que apresenta 6 elétrons distribuídos na camada de valência, mais precisamente nos subníveis 2s (possui 1 orbital) e 2p (possui 3 orbitais), ou seja, 2 elétrons no subnível s e 4 elétrons no subnível 2p. Assim, esse elemento possui dois orbitais incompletos.
-
Questão 2
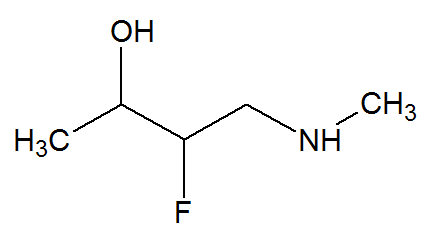
Dada a fórmula estrutural abaixo:
Qual dos elementos químicos presentes nessa estrutura sofre o fenômeno denominado de hibridização?
a) Hidrogênio
b) Carbono
c) Oxigênio
d) Nitrogênio
e) Flúor
Letra b). Dos elementos existentes nessa estrutura orgânica, apenas o carbono sofre o fenômeno da hibridização, já que na sua camada de valência existem 4 elétrons, distribuídos nos subníveis 2s (possui 1 orbital) e 2p (possui 3 orbitais), ou seja, esse elemento possui 2 elétrons no subnível s e 2 elétrons no subnível 2p, o que caracteriza a existência de apenas dois orbitais incompletos (em um orbital, só podem entrar dois elétrons) e resulta em duas ligações.
-
Questão 3
Para a realização de quatro ligações químicas, os átomos do elemento químico carbono devem sofrer um fenômeno em que os elétrons de sua camada de valência sofrem uma excitação energética. Assim, um elétron que estava emparelhado (no subnível 2s) é deslocado para o orbital 2p vazio. Por fim, os orbitais são unidos. Esse fenômeno é denominado:
a) Eletrólise
b) Salto quântico
c) Redução
d) Hibridização
e) Oxidação
Letra d). A união de orbitais atômicos incompletos é denominada hibridização. As demais alternativas estão incorretas porque:
a- É o fenômeno de produção de substâncias simples a partir da descarga elétrica em sistemas que contenham composto iônico fundido ou dissolvido em água.
b- É o fenômeno da transição do elétron de um nível menos energético para um mais energético.
c- É o fenômeno em que um átomo ganha elétrons.
e- É o fenômeno em que um átomo perde elétrons.
-
Questão 4
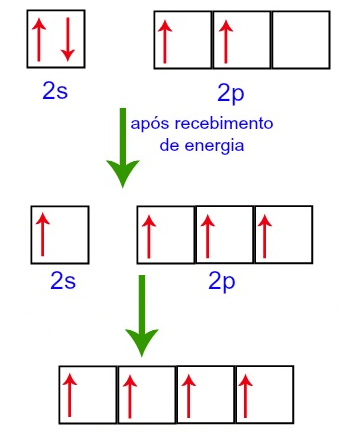
O elemento químico carbono possui número atômico 6, assim, a sua distribuição eletrônica é 1s2 2s2 2p2. Como cada orbital comporta no máximo 2 elétrons, e os subníveis s e p apresentam, respectivamente, 1 e 3 orbitais na camada de valência, haverá 2 elétrons no subnível 2s e dois orbitais p ocupados com 1 elétron.
Ao receber energia do meio externo, um elétron do subnível 2s é deslocado para o orbital vazio do subnível 2p. Em seguida, esses orbitais são unidos.
A respeito da união desses orbitais, a hibridização é
a) sp2
b) sp
c) s-sp2
d) s-sp3
e) sp3
Letra e). A hibridização é do tipo sp3, porque houve a união de um orbital s com três orbitais p. As outras alternativas estão incorretas porque:
a- Representa a hibridização do orbital s com dois orbitais p.
b- Representa a hibridização do orbital s com apenas um único orbital p.
c- Representação que caracteriza ligação química, e não hibridização.
d- Representação que caracteriza ligação química, e não hibridização.