Exercícios sobre Energia de Ativação
A energia de ativação é a menor energia necessária que deve ser fornecida aos reagentes para que a reação química ocorra.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
A figura seguinte mostra o diagrama de energia potencial de uma reação:
A + B → C + D
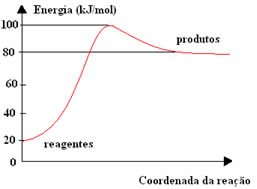
Qual é a energia de ativação para essa reação e qual deve ser a energia do complexo ativado em kJ/mol?
-
80 e 100.
-
20 e 100.
-
60 e 100.
-
80 e 20.
-
80 e 60.
Alternativa “a”.
Eativação = Enecessária para que a reação inicie – Eprópria dos reagentes
Eativação = 100-20 → Eativação = 80 kJJá a energia do complexo ativado é mostrada no gráfico, é a energia necessária para o complexo ativado ser formado, que é o ponto mais alto, isto é, 100 kJ/mol.
-
-
Questão 2
Considere a seguinte reação genérica:
A + B → C + D + calor
Assinale o gráfico (Entalpia X Caminho da reação) que melhor condiz com o tipo de reação descrita acima e a representação gráfica da energia de ativação indicada abaixo pela seta dupla:
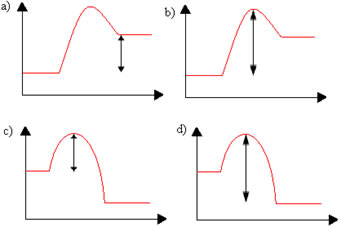
Alternativa “c”.
Visto que na reação dada no enunciado foi liberada energia, a energia dos produtos é menor que nos reagentes. Além disso, a energia de ativação é dada pela diferença entre a energia necessária para a reação iniciar e formar o complexo ativado (topo mais alto) e a energia que os reagentes já possuíam no início da reação.
-
Questão 3
(UFMG) Um palito de fósforo não se acende, espontaneamente, enquanto está guardado, mas basta um ligeiro atrito com uma superfície áspera para que ele, imediatamente, entre em combustão, com emissão de luz e calor.
Considerando-se essas observações, é CORRETO afirmar que a reação:a) é endotérmica e tem energia de ativação maior que a energia fornecida pelo atrito.
b) é endotérmica e tem energia de ativação menor que a energia fornecida pelo atrito.
c) é exotérmica e tem energia de ativação maior que a energia fornecida pelo atrito.
d) é exotérmica e tem energia de ativação menor que a energia fornecida pelo atrito.Alternativa “d”.
É exotérmica porque libera calor, como ocorre em toda combustão. A reação começa porque a energia fornecida pelo atrito é menor que a energia de ativação da reação e suficiente para ativar as primeiras moléculas e dar início à reação.
-
Questão 4
(Fafi-MG) No diagrama ao lado, o valor da energia de ativação corresponde (em kcal) a:
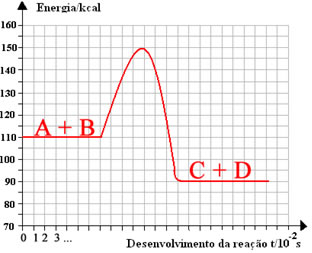
-
25
-
85
-
110
-
6
-
40
Alternativa “e”.
EAtivação = ENecessária para que a reação inicie – EPrópria dos reagentes
EAtivação = 150-110 → EAtivação = 40 kcal -