Exercícios sobre energia de ligação
Estes exercícios sobre energia de ligação abordam o cálculo do ΔH de uma reação por meio dos valores das energias de ligação entre os átomos.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
(Mackenzie-SP) O gás propano é um dos integrantes do GLP (gás liquefeito de petróleo) e, dessa forma, é um gás altamente inflamável. Abaixo está representada a equação química de combustão completa do gás propano.
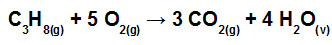
Na tabela, são fornecidos os valores das energias de ligação, todos nas mesmas condições de pressão e temperatura da combustão.
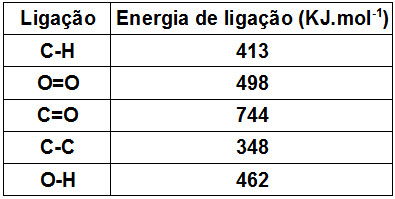
Assim, a variação de entalpia da reação de combustão de um mol de gás propano é igual a
a) – 1670 kJ.
b) – 6490 kJ.
c) + 1670 kJ.
d) – 4160 kJ.
e) + 4160 kJ.
Letra a). Com os valores de energia fornecidos pelo exercício, devemos fazer o seguinte para resolver a questão:
1º Passo: Escrever a equação representando a fórmula estrutural de cada um dos participantes da equação:
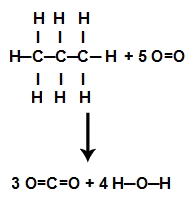
2º Passo: Calcular a energia total das ligações nos reagentes. Para isso, devemos multiplicar o valor da energia da ligação entre os átomos envolvidos pelo coeficiente estequiométrico na equação e pelo número de vezes que ela se repete na estrutura. Por fim, basta somar os valores.
Hreagentes = 2.(C-C) + 8. (C-H) + 5. (O=O)
Hreagentes = 2.(348) + 8.(413) + 5.(498)
Hreagentes = 696 + 3304 +2490
Hreagentes = 6490 KJ.mol-1
OBS.: Nos reagentes, a energia é sempre absorvida, logo, o valor dela nos reagenetes é sempre positivo.
3º Passo: Calcular a energia total das ligações nos produtos. Para isso, devemos multiplicar o valor da energia da ligação entre os átomos envolvidos pelo coeficiente estequiométrico na equação e pelo número de vezes que ela se repete na estrutura. Por fim, basta somar os valores.
Hprodutos = 6.(C=O) + 8. (O-H)
Hprodutos = 6.(744) + 8.(462)
Hprodutos = 4464 + 3696
Hprodutos = 8160 KJ.mol-1
OBS.: Nos produtos, a energia é sempre liberada, logo, o valor dela nos produtos é sempre negativo:
Hprodutos = - 8160 KJ.mol-1
4º Passo: Utilizar os valores encontrados para reagentes e produtos na seguinte fórmula:
ΔH= Hprodutos + Hreagentes
ΔH= - 8160 + 6490
ΔH= - 1670 KJ.mol-1
-
Questão 2
(UFRGS) A reação de cloração do metano, em presença de luz, é mostrada abaixo.
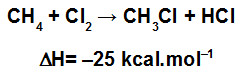
Considere os dados de energia das ligações abaixo?
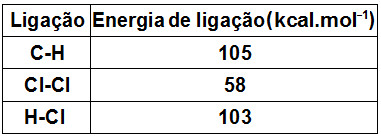
A energia da ligação C-Cl, no composto CH3Cl, é:
a) 33 kcal.mol–1.
b) 56 kcal.mol–1.
c) 60 kcal.mol–1.
d) 80 kcal.mol–1.
e) 85 kcal.mol–1.
Letra e). Com os valores de energia de ligação e o ΔH fornecidos pelo exercício, devemos fazer o seguinte para resolver a questão:
1º Passo: Escrever a equação representando a fórmula estrutural de cada um dos participantes da equação:
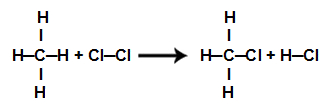
2º Passo: Calcular a energia total das ligações nos reagentes. Para isso, devemos multiplicar o valor da energia da ligação entre os átomos envolvidos pelo coeficiente estequiométrico na equação e pelo número de vezes que ela se repete na estrutura. Por fim, basta somar os valores.
Hreagentes = 4.(C-H) + 1. (Cl-Cl)
Hreagentes = 4.(105) + 1.(58)
Hreagentes = 420 + 58
Hreagentes = 478 Kcal.mol-1
OBS.: Nos reagentes, a energia é sempre absorvida, logo, o valor dela nos reagenetes é sempre positivo.
3º Passo: Calcular a energia total das ligações nos produtos. Para isso, devemos multiplicar o valor da energia da ligação entre os átomos envolvidos pelo coeficiente estequiométrico na equação e pelo número de vezes que ela se repete na estrutura. Por fim, basta somar os valores.
Hprodutos = 3.(C-H) + 1.(C-Cl) + 1.(H-Cl)
Hprodutos = 3.(105) + 1.(C-Cl) + 1.(103)
Hprodutos = 315 + (C-Cl) + 103
Hprodutos = [418 + C-Cl)] Kcal.mol-1
OBS.: Nos produtos, a energia é sempre liberada, logo, o valor dela nos produtos é sempre negativo:
Hprodutos = - [418 + C-Cl)] Kcal.mol-1
4º Passo: Utilizar os valores encontrados para reagentes e produtos, bem como o valor fornecido para o ΔH, na seguinte fórmula:
ΔH= Hprodutos + Hreagentes
- 25= - [418 + C-Cl)] + 478
- 25 = - 418 - (C-Cl) + 478
(C-Cl) = - 418 + 478 + 25
ΔH= + 85 Kcal.mol-1
-
Questão 3
A amônia (NH3) é uma substância muito utilizada na fabricação de fertilizantes e produtos de limpeza. Uma forma de produzi-la é por meio da síntese de Haber-Bosch, que ocorre em alta temperatura e pressão. Abaixo temos a equação que representa essa síntese:
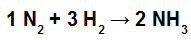
Veja o valor das energias de ligação entre os átomos:
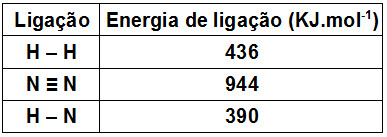
Determine a entalpia de formação de 1 mol de amônia.
a) –78 kJ/mol.
b) –44 kJ/mol.
c) +54 kJ/mol.
d) +98 kJ/mol.
e) +60 kJ/mol.
Leta b). Com os valores de energia fornecidos pelo exercício, devemos fazer o seguinte para resolver a questão:
1º Passo: Escrever a equação representando a fórmula estrutural de cada um dos participantes da equação:
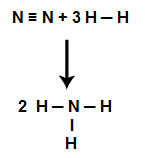
2º Passo: Calcular a energia total das ligações nos reagentes. Para isso, devemos multiplicar o valor da energia da ligação entre os átomos envolvidos pelo coeficiente estequiométrico na equação e pelo número de vezes que ela se repete na estrutura. Por fim, basta somar os valores.
Hreagentes = 1.(N≡N) + 3. (H-H)
Hreagentes = 1.(944) + 3.(436)
Hreagentes = 944 + 1308
Hreagentes = 2252 KJ.mol-1
3º Passo: Calcular a energia total das ligações nos produtos. Para isso, devemos multiplicar o valor da energia da ligação entre os átomos envolvidos pelo coeficiente estequiométrico na equação e pelo número de vezes que ela se repete na estrutura. Por fim, basta somar os valores.
Hprodutos = 6.(N-H)
Hprodutos = 6.(390)
Hprodutos = 2340 KJ.mol-1
Nos produtos, a energia é sempre liberada, logo, Hprodutos = - 2340 KJ.mol-1.
4º Passo: Utilizar os valores encontrados para reagentes e produtos na seguinte fórmula:
ΔH = Hprodutos + Hreagentes
ΔH = - 2340 + 2252
ΔH = - 88 KJ.mol-1
5º Passo: Como o exercício pede a entalpia de formação de 1 mol de NH3 e, na equação, temos 2 mol, devemos dividir o valor encontrado por dois:
ΔH = - 88
2ΔH = - 44 KJ.mol-1
-
Questão 4
O óxido nítrico é produzido por células endoteliais, como as que formam a camada mais interna dos vasos sanguíneos. Ele promove o relaxamento do músculo liso da parede do vaso, fazendo com que este se dilate, aumentando o fluxo sanguíneo e diminuindo a pressão arterial. Laboratorialmente, uma forma de produzir o óxido nítrico é por meio da reação (cujo ΔH = + 90 kJ.mol–1) entre os gases nitrogênio e oxigênio, representada abaixo:
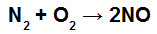
Se as energias de ligação entre os átomos N≡N e O=O valem, respectivamente, 950 kJ.mol–1 e 500 kJ.mol–1, qual é o valor da energia de ligação entre os átomos de nitrogênio e oxigênio no óxido nítrico?
a) 735 kJ.mol–1.
b) 680 kJ.mol–1.
c) 536 kJ.mol–1.
d) 537 kJ.mol–1.
e) 356 kJ.mol–1.
Letra b)
Para a resolução, faça o seguinte:
1º Passo: Escrever a equação representando a fórmula estrutural de cada um dos participantes da equação:
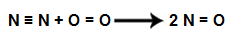
2º Passo: Calcular a energia total das ligações nos reagentes:
Hreagentes = 1.(N≡N) + 1. (O=O)
Hreagentes = 1.(950) + 1.(500)
Hreagentes = 950 + 500
Hreagentes = 1450 KJ.mol-1
3º Passo: Calcular a energia total das ligações nos produtos:
Hprodutos = 2.(N=O)
Hprodutos = 2.(N=O) KJ.mol-1
Nos produtos, a energia é sempre liberada, logo, o seu valor é negativo:
Hprodutos = - 2.(N=O) KJ.mol-1
4º Passo: Utilizar os valores encontrados para reagentes e produtos, bem como o valor fornecido para o ΔH, na seguinte fórmula:
ΔH= Hprodutos + Hreagentes
90 = - [2.(N=O)] + 1450
90 = - 2.(N=O) + 1450
2.(N=O) = 1450 – 90
2.(N=O) = 1360
(N=O) = 1360
2(N=O) = + 680 KJ.mol-1