Exercícios sobre entalpia de neutralização
Estes exercícios sobre entalpia de neutralização exigem conhecimentos sobre a definição desse calor de reação, como ele pode ser calculado e o tipo de reação que o define.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(UFRGS) A reação de neutralização entre um ácido forte e uma base forte libera uma quantidade de calor constante e igual a 58 kJ por mol de H2O formado. Das reações representadas a seguir, apresenta ∆H = -58 kJ/mol a reação:
a) NH4OH + HCl → NH4Cl + H2O
b) H2S + NaOH → NaHS + H2O
c) KOH + HCl → KCl + H2O
d) H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O
e) HCN + CuOH → CuCN + H2O
Alternativa “c”.
a) NH4OH + HCl → NH4Cl + H2O
Reação entre base fraca e ácido forte.b) H2S + NaOH → NaHS + H2O
Reação entre ácido fraco e base forte.c) KOH + HCl → KCl + H2O
Reação entre base forte e ácido forte, liberando 1 mol de água. Essa é a opção correta.d) H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O
Reação entre ácido forte e base forte. Porém, há 2 mols de água liberada.e) HCN + CuOH → CuCN + H2O:
Reação entre ácido fraco e base fraca -
Questão 2
A partir da reação:
H+(aq) + OH-(aq) → H2O(l) ∆H = - 57,7 kJ/mol
reagimos 2 mol de HCl e 2 mol de KOH, ambos eletrólitos fortes. Qual será o calor liberado ou absorvido nessa reação?
a) Libera 57,7 kJ.
b) Absorve 57,7 kJ.
c) Libera 28,85 kJ.
d) Libera 115,4 kJ.
e) Absorve 115,4 kJ.
Alternativa “d”.
As reações de neutralização sempre liberam calor, sendo exotérmicas, e a entalpia (energia global do sistema, ∆H) sempre é negativa, ou seja, menor que zero.
Reagindo 1 mol de HCl com 1 mol de KOH, são liberados 57,7 kJ:
1 HCl + 1 KOH → 1 KCl + 1 H2O(l) ∆H = - 57,7 kJ/molEntão, se reagirmos 2 mol de HCl e 2 mol de KOH, a quantidade de energia liberada será o dobro de 57,7 kJ, isto é, 115,4 kJ.
2 HCl + 2 KOH → 2 KCl + 2 H2O(l) ∆H = - 115,4 kJ/mol -
Questão 3
Qual das reações a seguir permite definir entalpia de neutralização?
a) 2 HCl(aq) + 2 NaOH(aq) → 2 NaCl(aq) + 2 H2O(l)
b) 3 HCN(aq) + 3 NaOH(aq) → 3 NaCN(aq) + 3 H2O(l)
c) ½ H2SO4(aq) + NaOH(aq) →½ Na2SO4(aq) + H2O(l)
d) H2S(aq) + 2 NaOH(aq) → Na2S(aq) + 2 H2O(l)
e) 1 H2SO4(aq) + 2 KOH(aq) → 1 K2SO4(aq) + 2 H2O(l)
Alternativa “c”.
Essa é a única das reações apresentadas que define a entalpia de neutralização, que é o calor liberado na formação de 1 mol de água a partir da reação entre 1 mol de cátions hidrogênio com 1 mol de ânions hidroxila. Veja:
½ H2SO4(aq) + NaOH(aq) →½ Na2SO4(aq) + H2O(l)
É o mesmo que:
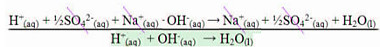
Reação que define entalpia de neutralização -
Questão 4
(PUC-RIO-2007) Considere calor de neutralização como a variação de entalpia na reação de um mol de H+ com um mol de OH-, formando um mol de H2O. Um experimento envolveu a reação de 2,00 g de NaOH contidos em solução aquosa de hidróxido de sódio com HCl suficiente para reação completa, contido em solução aquosa de ácido clorídrico, representada na equação abaixo:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Um estudante, usando os valores obtidos no experimento e a expressão Q = m.c.∆T, encontrou para essa reação a liberação de 660 cal. Sabendo-se que 1 cal equivale a 4,18 J, é correto afirmar que a variação de entalpia de neutralização, em kJ mol-1, é, de acordo com os algarismos significativos dos valores medidos, igual a:
a) 13,2.
b) 26,4.
c) 55,2.
d) 110.
Alternativa “c”.
A massa molar do NaOH é = 23 + 16 + 1 = 40 g/mol.
Vamos descobrir quantos mols reagiram, pois foram usados apenas 2 g de NaOH:
40 g----- 1 mol
2 g ------ x
x = 0,05 molAgora vamos passar a energia liberada de cal para kJ:
1 cal ---- 4,18 J
660 cal --- y
y = 2758,8 J1 kJ ---- 1000 J
w ------ 2758,8 J
w = 2,7588 kJMas a energia liberada foi para 0,05 mol. Precisamos descobrir a variação de entalpia de neutralização em kJ/mol:
2,7588 kJ------ 0,05 mol
z -------- 1 mol
z = 55,2 kJ/mol.