Exercícios sobre entalpia
Exercícios sobre entalpia (energia interna que as moléculas de uma substância possuem) e sobre a variação da entalpia (ΔH) de processos endotérmicos e exotérmicos.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(UFSM-RS) Considere o seguinte gráfico:
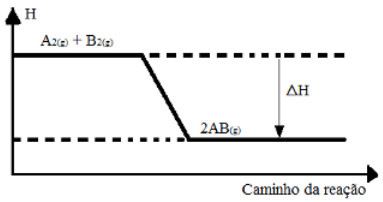
Gráfico de variação de entalpia de uma reação genéricaDe acordo com o gráfico acima, indique a opção que completa, respectivamente, as lacunas da frase a seguir:
“A variação da entalpia,>ΔH, é ........; a reação é .......... porque se processa ............... calor.”
a) positiva, exotérmica, liberando
b) positiva, endotérmica, absorvendo
c) negativa, endotérmica, absorvendo
d) negativa, exotérmica, liberando
e) negativa, exotérmica, absorvendoAlternativa “d”.
Pelo gráfico podemos ver que a entalpia do produto é menor que a dos reagentes, o que significa que houve liberação de energia na forma de calor e a reação é exotérmica. Assim, a frase fica da seguinte forma:
“A variação da entalpia, >ΔH, é negativa; a reação é exotérmica porque se processa liberando calor.”
-
Questão 2
(Fuvest-SP) Quando 0,500 mol de etanol líquido sofre combustão total sob pressão constante, produzindo CO2 e H2O gasosos, a energia liberada é de 148 kcal. Na combustão de 3,00 mol de etanol, nas mesmas condições, a entalpia dos produtos, em relação à dos reagentes, é:
a) 74 kcal menor.
b) 444 kcal maior.
c) 444 kcal menor.
d) 888 kcal maior.
e) 888 kcal menor.
Resolução da questã
Alternativa “e”.
A combustão de 0,500 mol de etanol liberou 148 kcal. Visto que a entalpia de formação de uma substância é proporcional ao seu número de mol, podemos realizar uma regra de três para descobrir a variação de entalpia na combustão de 3,00 mol de etanol:
0,500 mol ------- 148 kcal
3,00 mol ------ >ΔH
>ΔH = 3,00 mol . 148 kcal0,0500 mol
>ΔH = 888 kcal. -
Questão 3
Analise as reações termoquímicas a seguir com os seus respectivos valores de variação de entalpia e classifique-as como endotérmicas ou exotérmicas:
a) CO(g) + ½ O2(g) → CO2(g) >ΔH = -282,6 kJ
b) S(rômbico) + O2(g) → SO2(g) >ΔH = -296,6 kJ
c) H2(g) + ½ O2(g) → H2O(g) >ΔH = -241,6 kJ
d) N2(g) + O2(g) → 2 NO(g) >ΔH = +179,7 kJ
e) Na(s) + H2O(l) → NaOH(aq) + ½ H2(g) >ΔH = -140 kJ
Alternativa “c”.
As reações exotérmicas possuem o >ΔH negativo e as endotérmicas possuem o >ΔH positivo. Assim, temos:
Exotérmicas: “a”, “b”, “c” e “e”.
Endotérmica: Somente a “d”.
-
Questão 4
Qual será o calor absorvido na reação a seguir quando a quantidade de carbono for igual a 36 g?
SnO2(g) + 2 C(grafite) → Sn(s) + 2 CO(g) >ΔH = 360 kJ
a) 360 kJ.
b) 480 kJ.
c) 540 kJ.
d) 720 kJ.
e) 1080 kJ.
Alternativa “c”.
Pela reação verificamos que 2 mols de carbono são responsáveis por 360 kJ de calor da reação. Podemos então aplicar esta regra de três:
12 g é a massa de 1 mol de carbono
36 g será a massa de ?
12 g ------ 1 mol
36 g----------- xx = 36 . 1
12
x = 3 mol de carbonoComo 3 mols constituem 1,5 multiplicado pela quantidade de matéria apresentada pelo carbono, o calor da reação aumenta proporcionalmente a esse valor:
>ΔH = 1,5 . 360 kJ