Exercícios sobre força intermolecular, temperatura e estado físico
Com estes exercícios, é possível avaliar seus conhecimentos sobre a relação entre força intermolecular, temperatura de fusão e ebulição e o estado físico das substâncias.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Assinale a alternativa que contém a ordem crescente da temperatura de ebulição das seguintes espécies químicas: Cl2; Ar; NO e HF. Dados: Cl: 35,5 g/mol; Ar: 40 g/mol; F: 19 g/mol; N: 14 g/mol; O: 16 g/mol.
a) Cl2 < Ar < NO < HF
b) HF > NO > Ar > Cl2
c) HF > NO > Cl2 > Ar
d) Cl2 > Ar > NO > HF
e) Ar < Cl2 < NO < HF
Letra e). Para colocar as substâncias em ordem crescente de temperatura de ebulição, inicialmente devemos determinar os tipos de força intermolecular, pois, quanto maior a força, maior o ponto de ebulição. Assim, seguindo esse princípio:
Ligação de hidrogênio > Dipolo-dipolo > dipolo induzido
-
Cl2: dipolo induzido, por ser apolar;
-
Ar: dipolo induzido, por ser apolar;
-
NO: dipolo-dipolo, por ser polar;
-
HF: ligação de hidrogênio, por ser polar e ter H ligado com F;
Dessa forma, sabemos que o HF tem o maior ponto de ebulição e que o NO tem o segundo maior. Para comparar Ar com Cl2, basta determinar a massa molar deles a partir das massas atômicas dadas no exercício.
-
Ar: tem massa 40 g/mol;
-
Cl2: 71 g/mol.
O composto de maior massa, com o mesmo tipo de força, sempre tem maior ponto de ebulição. Assim, a ordem crescente dos pontos de ebulição no exercício será:
Ar < Cl2 < NO < HF
-
-
Questão 2
Dada a tabela abaixo, contendo as substâncias HF, HCl, HBr e HI, e seus respectivos pontos de ebulição:
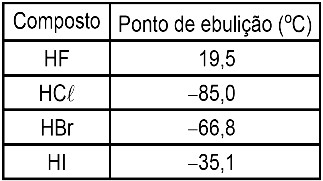
Podemos afirmar que:
a) O HF apresenta maior PE, pois tem na sua estrutura o haleto de menor tamanho, que torna a interação entre as moléculas mais fortes.
b) Ausência de polaridade de cada uma das substâncias.
c) Maior massa molecular do Hbr, quando comparado aos demais, favorece que ele tenha um menor ponto de ebulição.
d) A substância HF possui o maior ponto de ebulição. Isso se deve à formação de ligações de hidrogênio por essa substância.
e) O ponto de ebulição do HF deve-se à capacidade dessa substância de formar ligação do tipo iônica intermolecular.
Letra d). A resposta é a alternativa d, porque:
a- Falsa, pois o que torna a interação entre as moléculas de HF é o fato de o flúor ser o elemento de maior eletronegatividade da tabela periódica.
b- Falsa, pois todas as moléculas são diatômicas e com elementos diferentes, por essa razão, todas são polares.
c- Falsa, pois o HBr não apresenta a maior massa molar (1 g/mol do H e 80 g/mol do Br), e sim o HI (1 g/mol do H e 127 g/mol do I). Além disso, a maior massa (para compostos com mesmo tipo de força intermolecular) resulta em maior ponto de ebulição.
d- Verdadeira, pois ligação de hidrogênio ocorre em moléculas polares, e ter H ligado com F, O, ou N.
e- Falsa, pois o HF é um composto molecular. Ele não possui ligação iônica por não apresentar metal em sua composição.
-
Questão 3
(IFGO) Considere o quadro a seguir. Ele apresenta as temperaturas de fusão e de ebulição das substâncias Cl2, ICl e I2:
.jpg)
Considerando-se essas substâncias e suas propriedades, é correto afirmar que:
a) No Cl2, as interações intermoleculares são mais fortes que no I2.
b) Nas condições normais de temperatura e pressão, o Cl2 é gasoso, o ICl é líquido e o I2 é sólido.
c) Na molécula do ICl, a nuvem eletrônica da ligação covalente está mais deslocada para o átomo de cloro.
d) No ICl, as interações intermoleculares são, exclusivamente, do tipo dipolo instantâneo–dipolo induzido.
e) O ponto de fusão da molécula de I2 é o maior das três substâncias em função das suas interações intermoleculares serem mais intensas.
Letra c). A resposta é a letra c, porque:
a- Falsa, ambos os compostos são apolares e interagem por dipolo induzido, porém o composto de maior massa, I2, sempre tem maior interação intermolecular. Nesse exercício, temos Cl2 (71 g/mol) e I2 (254 g/mol).
b- Falsa, nas condições normais de temperatura e pressão, a temperatura é de 0 oC, o que faz com que o Cl2 seja líquido, o ICl sólido, e o I2 sólido.
c- Verdadeiro, a nuvem eletrônica está deslocada para o lado do cloro no ICl pelo fato de o cloro ser mais eletronegativo.
d- Falso, pois o ICl é diatômico, com elementos diferentes, logo, é polar e apresenta força intermolecular dipolo-dipolo.
e- Falsa, pois o I2 apresenta força intermolecular dipolo induzido que é menos intensa que o dipolo-dipolo do ICl, porém a diferença de massa entre suas moléculas é muito grande.
-
Questão 4
(UFC-CE) Sabendo-se que a temperatura de ebulição de uma substância depende da intensidade das forças intermoleculares presentes, assinale a alternativa que corretamente apresenta as substâncias em ordem crescente de temperatura de ebulição.
a) H2, N2, O2, Br2
b) N2, Br2, O2, Br2
c) Br2, O2, N2, H2
d) Br2, N2, H2, O2
e) O2, Br2, N2, H2
Letra a). Nesse exercício, há apenas moléculas diatômicas com átomos iguais, fazendo com que todas sejam apolares e interajam por dipolo induzido. Assim, para colocar as moléculas em ordem crescente, será necessário determinar a massa molecular, pois, quanto maior a massa, maior a interação e maior o ponto de ebulição:
-
H2: 2 g/mol;
-
N2: 28 g/mol;
-
Br2: 160 g/mol;
-
O2: 32 g/mol.
Portanto, a ordem crescente (menor para o maior) é:
H2, N2, O2, Br2
-
