Exercícios sobre gráficos das curvas de solubilidade
Resolva nossa lista de exercícios sobre curvas de solubilidade e teste sua habilidade em determinar e comparar a solubilidade de um ou mais sais em um gráfico.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
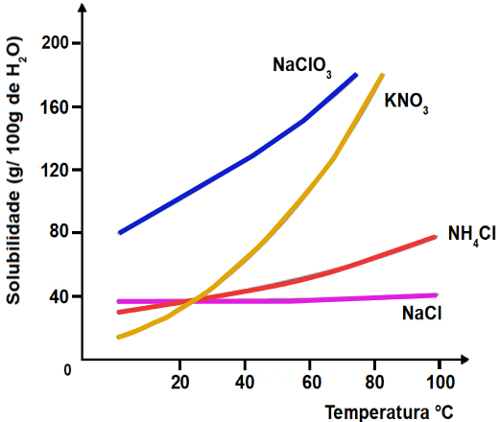
O gráfico abaixo indica as curvas de solubilidade de quatro diferentes sais:
Qual destes sais apresenta maior solubilidade a 40oC?
a) NaClO3
b) KNO3
c) NH4Cl
d) NaCl
Letra a)
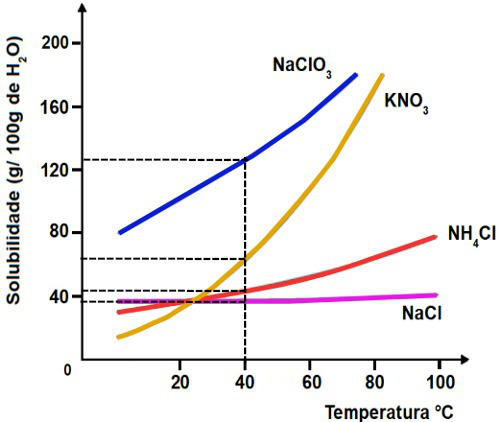
Para determinar qual dos sais presentes no gráfico apresenta maior solubilidade, basta tracejarmos uma linha, a partir da temperatura 40o C, no eixo x até cada tocar as curvas. Em seguida, devemos tracejar outra linha até a solubilidade presente no eixo y. Observe:
Como a massa dissolvida de NaClO3 em 100 g de H2O a 40oC é maior que a massa dissolvida dos outros sais, logo o clorato de sódio é o mais solúvel.
-
Questão 2
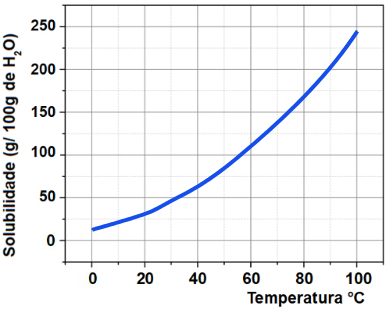
A curva de solubilidade da substância KNO3 dissolvida em 100 g de água em função da temperatura é mostrada abaixo.
Se tivermos 40g de água a 50o C, qual será a massa de KNO3 dissolvida?
a) 28 g
b) 56 g
c) 33,6 g
d) 45 g
Letra c)
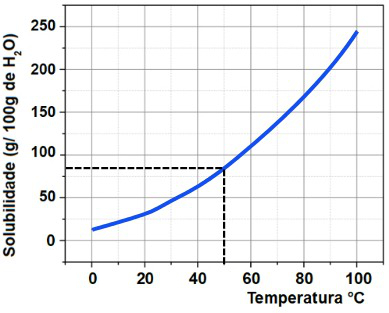
Para determinar a massa em gramas de KNO3 que pode ser dissolvida em 100 gramas de H2O, devemos, inicialmente, tracejar uma linha a partir da temperatura 50o C no eixo x até atingir a curva. Em seguida, devemos tracejar uma linha no eixo y até a solubilidade presente.
Como a marca zero da solubilidade nesse gráfico é dada mais acima, a massa de soluto dissolvida por 100 gramas de H2O é de aproximadamente 84 g.
Por fim, montamos uma regra de três simples para calcular a massa de KNO3 que pode ser dissolvida por 40 gramas de H2O:
100g de H2O------------- 84g de KNO3
40g de H2O------------ x
100.x = 40.84
100x = 3360
x = 3360
100x = 33,6g de KNO3
-
Questão 3
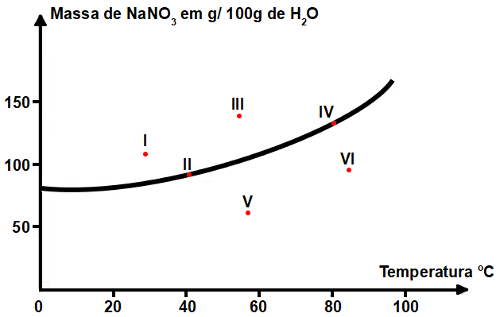
(UFMG) Seis soluções aquosas de nitrato de sódio (NaNO3), numeradas de I a VI, foram preparadas em diferentes temperaturas dissolvendo-se diferentes massas de NaNO3 em 100 g de água. Em alguns casos, o NaNO3 não se dissolveu completamente. Este gráfico representa a curva de solubilidade de NaNO3 em função da temperatura. Os seis pontos correspondem aos sistemas preparados:
A partir da análise desse gráfico, é CORRETO afirmar que os dois sistemas em que há precipitado são:
a) I e II
b) I e III
c) IV e V
d) V e VI
Letra b)
Quando as soluções apresentam quantidade de soluto acima da saturação (que é indicada por qualquer ponto na curva) há precipitado. Logo, os pontos I e III indicam uma solução com precipitado, já que estão acima da curva de solubilidade.
-
Questão 4
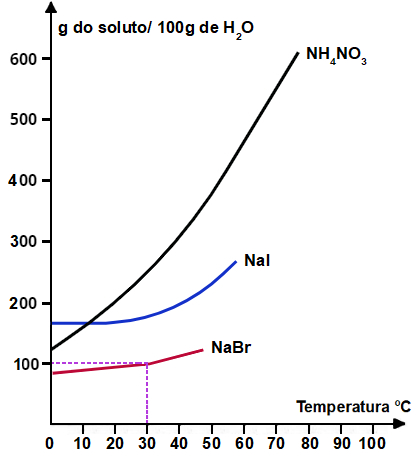
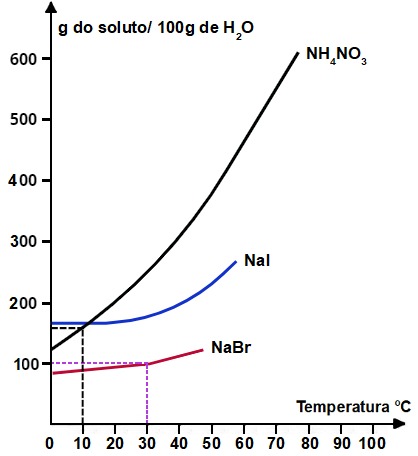
Observe o gráfico abaixo e analise as afirmações de I a IV.
I- Se acrescentamos 250 g de NH4NO3 a 50g de água a 60°C, obteremos uma solução saturada com corpo de chão.
II- A dissolução do NH4NO3 e do Nal em água ocorre com liberação e absorção de calor, respectivamente.
III- A 40°C, o Nal é mais solúvel que o NaBr e menos solúvel que o NH4NO3.
IV- Quando uma solução aquosa saturada de NH4NO3, inicialmente preparada a 60°C, for resfriada a 10°C, obteremos uma solução insaturada.
Está correto apenas o que se afirma em:
a) I e II
b) I e III
c) I e IV
d) II e III
e) III e IV
Letra b)
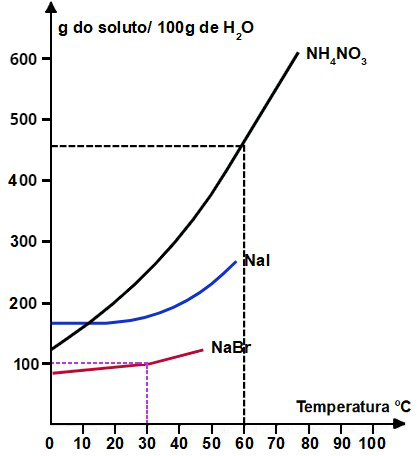
I- Verdadeira: quando tracejamos uma linha a partir da temperatura 60oC no eixo x até a curva do NH4NO3 e, em seguida, tracejamos outra linha no eixo y até a solubilidade presente, podemos determinar a massa em gramas de NH4NO3 que pode ser dissolvida em 100 gramas de H2O.
Como observada na marcação, a massa de soluto dissolvida por 100 gramas de H2O a 60oC é de aproximadamente 460 g. Assim, montamos uma regra de três simples para calcular a massa de NH4NO3 que pode ser dissolvida em 50 gramas de H2O:
100g de H2O------------- 460g de NH4NO3
50g de H2O-------------- x
100.x = 50.460
100x = 23000
x = 23000
100x = 230g de NH4NO3
Assim, se adicionarmos 350 g de NH4NO3 em 50 g de água, formaremos uma solução saturada com corpo de fundo.
II- Falsa: se as curvas são ascendentes, significa que é possível dissolver uma maior quantidade de sais à medida que a temperatura aumenta. Por isso, eles são endotérmicos.
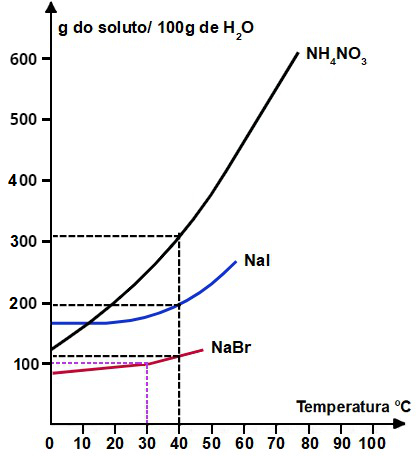
III- Verdadeira: quando tracejamos uma linha no eixo x a partir da temperatura 40oC até cada uma das curvas e, em seguida, tracejamos outra linha até a solubilidade presente no eixo y, confirmamos que Nal é mais solúvel que o NaBr e menos solúvel que o NH4NO3.
IV- Falsa: quando tracejamos uma linha a partir da temperatura 10o C (já que conhecemos a solubilidade a 60oC) no eixo x até a curva do NH4NO3 e, em seguida, tracejamos outra linha até a solubilidade presente no eixo y, podemos determinar a massa em gramas de NH4NO3 que pode ser dissolvida em 100 gramas de H2O
Como observada na marcação, a massa de soluto dissolvida em 100 gramas de H2O a 10o C é de aproximadamente 160 g de NH4NO3. Logo, se preparada uma solução saturada a 60o C, teremos 460g dissolvidos. Ao resfriá-la, apenas 160g permanecerão dissolvidos (mantendo a solução saturada), sobrando 300g de corpo de fundo.