Exercícios sobre Gráficos no Equilíbrio Químico
Para resolver estes exercícios sobre gráficos usados no equilíbrio químico, é necessário saber interpretar os dados apresentados nas curvas e nos eixos da abcissa e ordenada.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Observe o gráfico abaixo de uma reação em que o equilíbrio químico é atingido:
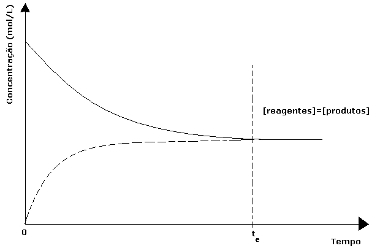
Gráfico de um equilíbrio químicoCom base nesse gráfico, podemos afirmar que nesse equilíbrio:
a) a concentração de produtos é maior que a de reagentes.
b) a concentração de reagentes é maior que a de produtos.
c) as concentrações de reagentes e produtos são iguais.
d) a reação inversa ocorre com maior intensidade.
e) a reação inversa ocorre com menor intensidade.
Alternativa “c”.
No gráfico, no instante te, as reações direta e inversa igualam-se; nesse caso, as concentrações dos reagentes e dos produtos são iguais. Assim, o equilíbrio não está deslocado para nenhum lado, a intensidade de ambas as reações é a mesma.
-
Questão 2
O gráfico a seguir mostra a variação da concentração das espécies químicas de um sistema até chegar à situação de equilíbrio:
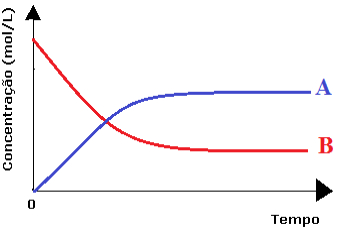
Gráfico de equilíbrio químico mostrando a variação da concentração com o tempoQual das alternativas abaixo indica corretamente a situação de equilíbrio?
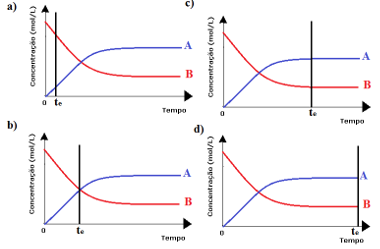
Alternativas de questão sobre equilíbrio químico Título: Questão sobre equilíbrio químicoAlternativa “c”.
A partir do momento apresentado na alternativa “c”, a concentração dos reagentes (simbolizada pela letra “B”) e a concentração dos produtos (simbolizada pela letra “A”) permanecem constantes.
-
Questão 3
(UFRS) O gráfico a seguir representa a evolução de um sistema onde uma reação reversível ocorre até atingir o equilíbrio.
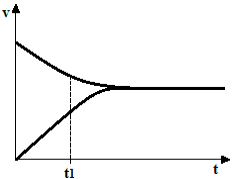
Gráfico de exercício sobre equilíbrio químico Título: Gráfico de exercícioSobre o ponto t1, nesse gráfico, pode-se afirmar que indica:
a) uma situação anterior ao equilíbrio, pois as velocidades das reações direta e inversa são iguais.
b) um instante no qual o sistema já alcançou o equilíbrio.
c) uma situação na qual as concentrações de reagentes e produtos são necessariamente iguais.
d) uma situação anterior ao equilíbrio, pois a velocidade da reação direta está diminuindo e a velocidade da reação inversa está aumentando.
e) um instante no qual o produto das concentrações dos reagentes é igual ao produto das concentrações dos produtos.
Alternativa “d”.
-
Questão 4
(Fuvest-SP) No gráfico, estão os valores das pressões parciais de NO2 e de N2O4 para diferentes misturas desses dois gases, quando, a determinada temperatura, é atingido o equilíbrio:
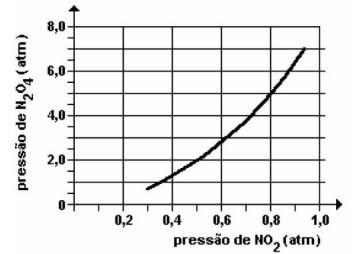
Gráfico de pressões parciais de gases em equilíbrio Título: Gráfico de pressõesCom os dados desse gráfico, pode-se calcular o valor da constante (Kp) do equilíbrio atingido naquela temperatura. Seu valor numérico é próximo de
a) 1.
b) 2.
c) 4.
d) 8.
e) 12.Alternativa “d”.
Kp = pN2O4
(pNO2)2Tomando-se um ponto na curva das pressões parciais, temos:
pN2O4 = 3,0 atm e pNO2 = 0,6 atm
Kp = 3,0
(0,6)2Kp ≈ 8,3 ou Kp ≈ 8