Exercícios sobre hibridização do tipo sp
Estes exercícios sobre hibridização do tipo sp abordam o número de ligações sigma/pi e os tipos de ligações presentes em uma cadeia.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
(UFV MG) Considere a fórmula estrutural abaixo:
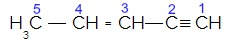
São feitas as seguintes afirmativas:
I. O átomo de carbono 5 forma 4 ligações (sigma)
II. O átomo de carbono 3 forma 3 ligações (sigma) e 1 ligação (pi).
III. O átomo de carbono 2 forma 3 ligações (pi) e 1 ligação (sigma)
IV. O total de ligações (pi) na estrutura é igual a 3.
Assinale a alternativa CORRETA:
a) Todas as afirmativas são corretas.
b) Apenas as afirmativas I e II são corretas.
c) Apenas as afirmativas I, II e IV são corretas.
d) Apenas as afirmativas I e IV são corretas.
e) Apenas as afirmativas II e III são corretas.
Letra c). O item I está correto porque toda ligação simples é sigma e o carbono 5 tem quatro ligações simples. O II está correto porque o carbono três realiza duas ligações simples (sigmas) e uma ligação dupla (uma sigma e uma pi). O item III está incorreto porque o carbono 2 realiza uma ligação simples (sigma) e uma ligação tripla (duas pi e uma sigma). O item IV está correto porque temos ligações pi apenas na ligação dupla (uma) e na ligação tripla (duas).
-
Questão 2
Dada a estrutura do pent-2-ino abaixo, quantos átomos de carbono sp ela apresenta?
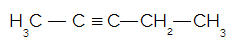
a) 1
b) 2
c) 3
d) 4
e) 5
Letra b). Um carbono apresenta hibridização do tipo sp quando possui duas ligações do tipo pi. A ligação do tipo pi somente está presente em ligações do tipo dupla ou tripla. A estrutura do pent-2-ino apresenta uma ligação tripla (duas pi), assim, os dois carbonos envolvidos nessa ligação apresentam hibridização do tipo sp.
-
Questão 3
Dada a fórmula estrutural do 3-metil-but-1-ino:
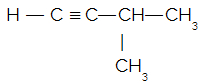
Quantas ligações sigmas do tipo s-sp existem na estrutura?
a) 1
b) 2
c) 3
d) 4
e) 5
Letra a). Para que tenhamos uma ligação do tipo s-sp, é necessária a existência de carbono (com duas ligações pi) que possua esse tipo de hibridização e de hidrogênio ligado a ele. Como temos uma ligação tripla (duas ligações pi) entre dois carbonos, temos, então, dois carbonos com hibridização sp. Como apenas um desses carbonos apresenta hidrogênio, há apenas uma ligação do tipo s-sp.
-
Questão 4
(UFPE) A partir da estrutura do composto abaixo, podemos afirmar que:
.jpg)
00. Os carbonos 1 e 2 apresentam hibridização sp2.
01. Os carbonos 3 e 4 apresentam hibridização sp3.
02. O carbono 5 apresenta hibridização sp.03. Os carbonos 1 e 2 apresentam duas ligações pi π entre si.
04. Os carbonos 3 e 4 apresentam duas ligações pi π e uma sigma σ entre si.
Somatório igual a 4. O item 00 está correto. O item 01 está incorreto porque os carbonos 3 e 4 apresentam hibridização do tipo sp pelo fato de apresentarem uma ligação tripla entre eles (duas ligações pi). O item 02 está incorreto porque a hibridização que o carbono 5 apresenta é a sp3 pelo fato de ele apresentar quatro ligações sigmas (simples). O item 03 está errado porque, entre os carbonos 1 e 2, há apenas uma única ligação pi, já que entre eles existe apenas uma ligação dupla (uma sigma e uma pi). O item 04 está correto.