Exercícios sobre a Lei de Proust
A Lei de Proust, ou Lei das Proporções Constantes, diz que quando várias substâncias se combinam para formar um composto, sempre o fazem numa relação de massa definida.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Sabe-se que 28 g de nitrogênio reagem completamente com 6 g de hidrogênio, formando amônia. Qual será a massa, em gramas de amônia formada, quando 140 g de nitrogênio reagir com hidrogênio suficiente para completar a reação?
170g.
Utilizando a Lei de Lavoisier, sabemos que a massa dos produtos é igual à soma das massas dos reagentes, assim, temos:
Nitrogênio + Hidrogênio → amônia
28 g 6 g xx = 28 g + 6g = 34 g
Agora utilizaremos a Lei de Proust, que nos diz que a proporção das massas dos reagentes e dos produtos deve ser mantida constante. Assim, se a massa do nitrogênio passou de 28 g para 140 g, quer dizer que ela aumentou 5 vezes, por isso, as outras massas também terão que aumentar 5 vezes:
Nitrogênio + Hidrogênio → amônia
140 g 30 g 170gPortanto, a massa da amônia formada nesse caso é de 170 g.
Poderíamos ter utilizado também uma regra de três simples para resolver essa questão:
Nitrogênio + Hidrogênio → amônia
28g----------------------------------34g
140g--------------------------------y
y = 170g -
Questão 2
Foram realizados três experimentos envolvendo a reação de síntese entre o nitrogênio e o hidrogênio para a obtenção da amônia. Os dados obtidos estão alistados na tabela a seguir. Demonstre a Lei de Proust baseando-se nesses resultados.
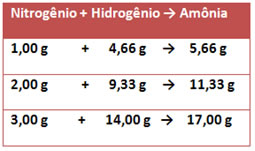
A lei de Proust diz que a proporção em massa das substâncias que reagem e que são produzidas numa reação é fixa, constante e invariável. Proust chegou a essa conclusão observando que a decomposição de diferentes massas de uma substância composta produzia massas de substâncias simples sempre numa mesma proporção.
Massa de gás hidrogênio= 1,00 = 2,00 = 3,00 = 0,214
Massa de gás nitrogênio 4,66 9,33 14,00 -
Questão 3
(Vunesp-SP) Duas amostras de carbono puro de massa 1,00 g e 9,00 g foram completamente queimadas ao ar. O único produto formado nos dois casos, o dióxido de carbono gasoso, foi totalmente recolhido e as massas obtidas foram 3,66 g e 32,94 g, respectivamente.
Utilizando estes dados:
a) Demonstre que nos dois casos a Lei de Proust é obedecida;
b) determine a composição do dióxido de carbono, expressa em porcentagem em massa de carbono e de oxigênio.
a) A lei de Proust diz que a proporção em massa das substâncias que reagem e que são produzidas numa reação é fixa, constante e invariável. Proust chegou a essa conclusão observando que a decomposição de diferentes massas de uma substância composta produzia massas de substâncias simples sempre numa mesma proporção.
___Massa de carbono puro__= 1,00 = 9,00 = 0,273
Massa de dióxido de carbono 3,66 32,94b) 27% de carbono; 72,2% de oxigênio.
C(s) + O2(g) → CO2(g)
1,00 g x 3,66Primeiramente, descobrimos a massa de oxigênio que reagiu, por meio da Lei de Lavoisier, que diz que a massa total do produto é a soma das massas dos reagentes:
1,00 g + x = 3,66 g
x = (3,66-1,00) g
x = 2,66gAgora, por meio de uma regra de três simples, descobrimos as porcentagens:
3,66 ---- 100% 3,66 ---- 100%
1,00 ----- y 2,66 ---- w
y = 27% w = 72% -
Questão 4
(UEL-PR) 46,0 g de sódio reagem com 32,0 goxigênio formando peróxido de sódio. Quantos gramas de sódio serão necessários para obter 156 g de peróxido de sódio?
a) 23,0
b) 32,0
c) 69,0
d) 78,0
e) 92,0
Alternativa “e”.
Sódio + oxigênio → peróxido de sódio
46,0 g 32,0g xSomando as massas dos reagentes, temos a massa do produto:
x = 46,0 g + 32,0 g = 78, 0g
Agora fazemos a regra de três, pois, segundo a Lei de Proust, a proporção das massas deve ser mantida constante:
sódio + oxigênio → peróxido de sódio
46,0g ----------------------- 78,0g
y --------------------------156g
y = 92,0g