Exercícios sobre ligação sigma
Esta lista de exercícios aborda a ligação sigma a partir da determinação da quantidade desse tipo de ligações covalentes em uma molécula.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
As bactérias são micro-organismos que durante muitos e muitos anos foram, e continuam sendo, um problema para a medicina, principalmente pelo potencial que elas apresentam em provocar infecções durante cirurgias. Desde o ano de 1867, soluções à base de fenol são utilizadas para eliminar ou diminuir a quantidade de bactérias. Essas soluções são denominadas antissépticos, como a estrutura a seguir:
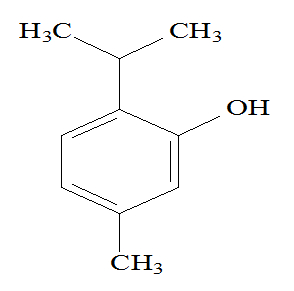
Com base na estrutura química acima, qual o número de ligações sigma presentes nela?
a) 20
b) 21
c) 22
d) 23
e) 24
Letra e). Em qualquer ligação estabelecida entre átomos, sempre existe uma ligação sigma, independentemente se a ligação for simples, dupla ou tripla. Nessa estrutura, podemos observar ligações simples e duplas, porém não está explícita a ligação simples entre o oxigênio e o hidrogênio no OH, bem como a ligação de alguns hidrogênios em alguns carbonos.
-
Questão 2
A fórmula estrutural a seguir pertence a uma substância denominada anlodipino, a qual é utilizada como vasodilatadora, isto é, que aumenta o diâmetro dos vasos sanguíneos, e hipotensora, cuja função é diminuir a pressão arterial.
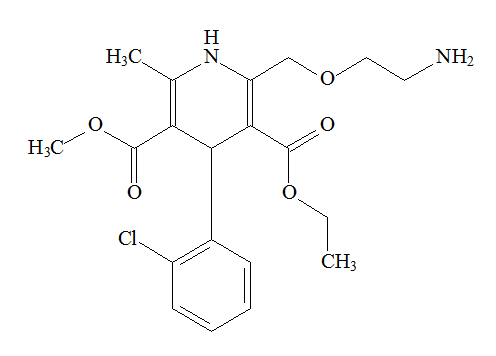
Analisando sua estrutura, podemos afirmar que se encontram nela quantas ligações sigma do tipo s-sp3?
a) 14
b) 15
c) 16
d) 17
e) 18
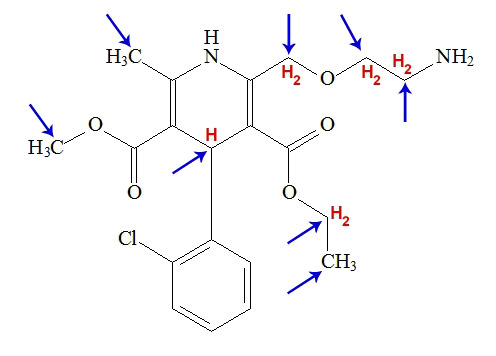
Letra e). Uma ligação sigma do tipo s-sp3 é aquela estabelecida entre um átomo de hidrogênio e um carbono saturado, ou seja, que só realiza ligações simples. Na estrutura a seguir, as setas azuis indicam os carbonos saturados e ainda os hidrogênios que a estrutura não mostra de forma explícita:
-
3 carbonos saturados com 3 hidrogênios: nove ligações sigma s-sp3;
-
4 carbonos saturados com 2 hidrogênios: oito ligações sigma s-sp3;
-
1 carbono saturado com 1 hidrogênio: uma ligação sigma s-sp3.
-
-
Questão 3
(UFPE) O ácido acetil salicílico (AAS) é um importante analgésico sintético:
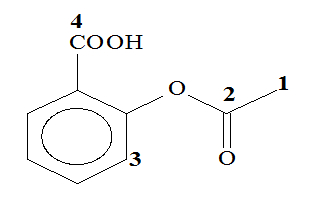
Sobre esse ácido e os átomos de carbono assinalados na figura acima, podemos afirmar que:
00. o carbono 1 tem hibridação sp3.
01. a ligação entre o carbono 2 e o oxigênio é do tipo sp2-p.
02. existem, ao todo, 4 ligações π (pi).
03. o carbono 3 forma ligações com ângulos de 120o entre si.
04. o carbono 4 pertence a um grupamento ácido carboxílico.
V-V-F-V-V. A seguir, a justificativa para cada item:
00. Verdadeiro. Como o carbono 1 realiza uma ligação simples, isso quer dizer que está ligado a três átomos de hidrogênio. Logo, como o carbono realiza só ligações simples, ele apresenta hibridização sp3.
01. Verdadeiro. O oxigênio apresenta o subnível p como mais energético e o carbono apresenta hibridização sp2 (já que realiza duas ligações simples e uma dupla).
02. Falso. No benzeno, há três ligações pi, mais uma na carboxila do carbono 4 e uma no carbono 2. Assim, ao todo, são cinco ligações pi.
03. Verdadeiro. O carbono 3 pertence ao benzeno e todos os carbonos do benzeno realizam uma ligação dupla e duas simples, logo, realizam hibridização sp2, na qual o carbono forma ângulo de 120o.
04. Verdadeiro. Porque há um carbono realizando uma ligação dupla com o oxigênio (O) e uma ligação simples com a hidroxila (OH).
-
Questão 4
(UFV-MG) No hidrocarboneto de fórmula estrutural representada abaixo, os átomos de carbono estão numerados de 1 a 7.
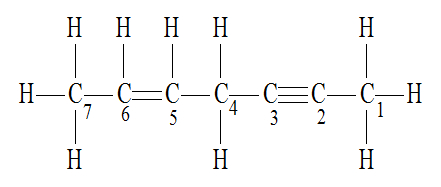
Sobre esse hidrocarboneto, são feitas as seguintes afirmativas:
I. O total de ligações π (pi) na estrutura é igual a 3.
II. O átomo de carbono 2 forma 3 ligações π (pi) e 1 ligação σ (sigma).
III. O átomo de carbono 5 forma 3 ligações σ (sigma) e 1 ligação π (pi).
IV. O átomo de carbono 1 forma 4 ligações σ (sigma).
São corretas apenas as afirmativas:
a) I, III e IV.
b) II e IV.
c) I e II.
d) I, II e IV.
Letra a). A alternativa a está correta porque:
I- Verdadeiro. A estrutura apresenta três ligações pi: uma entre os carbonos 5 e 6, pois em toda dupla há uma ligação sigma e uma pi, e duas ligações pi entre os carbonos 2 e 3, pois em toda tripla há uma ligação sigma e duas pi.
II- Falso. O átomo de carbono 2 apresenta duas ligações sigma e duas pi porque realiza uma ligação simples (sigma) e uma ligação tripla (duas pi e uma sigma).
III- Verdadeiro. O átomo de carbono 5 apresenta três ligações sigma e uma pi porque ele realiza duas ligações simples (toda ligação simples é sigma) e uma dupla (uma ligação sigma e uma pi).
IV- Verdadeiro. O carbono 1 tem quatro ligações sigma porque ele realiza quatro ligações simples (toda ligação simples é sigma).