Exercícios sobre meio neutro, ácido e básico
Estes exercícios sobre meio neutro, ácido e básico testarão seus conhecimentos sobre os critérios que envolvem essa classificação.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Veja a tabela a seguir com a faixa de pH de alguns líquidos do corpo humano:
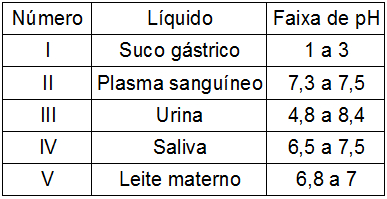
Marque aqueles que podem ser considerados básicos.
a) I e IV.
b) apenas o II.
c) I, II e III.
d) apenas o III
e) II, III e IV.
Letra e). Os líquidos II, III e IV podem ser considerados básicos porque sua faixa de pH supera o valor 7.
-
Questão 2
(UFAL) O caráter ácido, básico ou neutro de uma solução aquosa está diretamente relacionado com as concentrações dos íons H3O+ e OH– presentes na solução. Uma solução aquosa neutra, por definição, é aquela na qual, necessariamente,
a) [H3O+] = 0
b) [H3O+] = 10–7 mol/L
c) [H3O+] = 10–14 mol/L
d) [H3O+] = [OH-]
e) [OH] = 0
Letra d). Um meio neutro deve apresentar a concentração de hidrônios (H3O+) igual à concentração de hidroxilas (OH-).
-
Questão 3
(UFJF) Alguns animais aquáticos apresentam limites de resistência em relação ao pH da água onde habitam. Por exemplo, a faixa de pH de sobrevivência de camarões é 5,5-5,8 e a dos caramujos é 7,0-7,5. Considere as concentrações de H+ nas soluções A, B e C apresentadas na tabela a seguir.
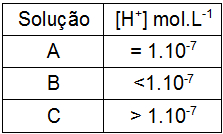
Sobre a sobrevivência desses animais nessas soluções, é CORRETO afirmar que:
a) somente os camarões sobreviveriam na solução A.
b) os camarões sobreviveriam na solução B.
c) os caramujos sobreviveriam na solução C.
d) somente os caramujos sobreviveriam na solução A.
e) ambos os animais sobreviveriam em qualquer uma das três soluções A, B ou C.
Letra d). Inicialmente, é importante compreender o tipo de soluções que temos na tabela.
Solução A: possui concentração de [H+] igual a 1.10-7, logo, é neutra, pois, quando a [H+] ou [OH-] é igual a 1.10-7, o meio é neutro. Para determinar o valor do pH, basta utilizar a expressão:
[H+] = 10-pH
1.10-7 = 10-pH
pH = 7
Solução B: possui concentração de [H+] menor que 1.10-7, logo, é básica, pois, nesse caso, a concentração de [H+] é menor que a de [OH-]. Para determinar o possível valor do pH, basta utilizar a expressão:
[H+] = 10-pH
1.10-8 = 10-pH
pH = 8, ou seja acima de 7
Solução C: possui concentração de [H+] maior que 1.10-7, logo, é ácida, pois, a concentração de [H+] é maior que a de [OH-]. Para determinar o possível valor do pH, basta utilizar a expressão:
[H+] = 10-pH
1.10-6 = 10-pH
pH = 6, ou seja, abaixo de 7
Com base no pH das soluções, os camarões sobreviveriam na solução C, uma vez que precisam de um pH menor que 7. Já os caramujos sobreviveriam tanto na solução A quanto na solução B, pois precisam de um pH a partir de 7.
-
Questão 4
A reação de saponificação é um processo químico de hidrólise alcalina em que o óleo utilizado para frituras em indústrias ou estabelecimentos comerciais é transformado em sabão. Se um sabão cujo pOH é igual a 2 for colocado na água, haverá um meio básico, neutro ou ácido? Qual será a concentração de íons hidrônio nesse meio?
a) ácido e 10−11 mol/L
b) básico e 10−2 mol/L
c) ácido e 10−3 mol/L
d) básico e 10−12 mol/L
e) neutro e 10−4 mol/L
Letra b). Como o exercício informa que o pOH é igual a 12, é interessante determinar o valor do pH.
pH + pOH = 14
pH + 12 = 14
pH = 14 – 12
pH = 12
Como o pH é maior que a referência convencional para um meio neutro (pH = 7), temos um meio básico. Para determinar a concentração de hidrônios, basta utilizar o valor do pH na seguinte expressão:
[H+] = 10-pH
[H+] = 10-12 mol/L