Exercícios sobre mistura de soluções com solutos diferentes sem reação química
Estes exercícios sobre soluções com solutos diferentes sem reação química exploram cálculos da concentração após a realização da mistura.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Em uma aula prática, um estudante realiza uma mistura utilizando 300 mL de solução aquosa de hidróxido de magnésio 4 mol/L, com 600 mL de solução aquosa de cloreto de magnésio de concentração 8,5 g/L. Qual será a concentração de cátions magnésio na solução final? Dados: (Mg = 24 g/mol Cl=35,5 g/mol, O=16 g/mol, H=1 g/mol):
a) 1,82 mol/L
b) 1,72mol/L
c) 1,62 mol/L
d) 1,42 mol/L
e) 1,52 mol/L
Letra d). O exercício fornece os seguintes dados:
-
Volume de solução [Mg(OH)2] = 300 mL
-
Concentração molar de solução [Mg(OH)2] = 4 mol/L
-
Volume de solução [MgCl2] = 600 mL
-
Concentração comum de solução [MgCl2] = 8,5 g/L
-
Volume final (VF) 900 mL (resultante da soma entre os volumes das soluções misturadas)
Para determinar a concentração de cátions magnésio na solução final, devemos realizar os seguintes passos:
1º Passo: Calcular a massa molar do MgCl2.
Para tal, devemos multiplicar a massa do elemento pela quantidade de átomos na fórmula e, em seguida, somar os resultados:
M = 1.24 + 2.35,5
M = 24 + 71
M = 95 g/mol
2º Passo: Calcular a concentração em quantidade de matéria da solução de MgCl2.
Para isso, basta dividir a concentração comum pela massa molar:
MMgCl2 = 8,5
95MMgCl2 = 0,09 mol/L (aproximadamente)
3º Passo: Calcular a concentração em quantidade de matéria da solução de Mg(OH)2 (MF1) após a mistura.
M1.V1 = MF1.VF
4.300 = MF1.900
MF1 = 1200
900MF1 = 1,33 mol/L (aproximadamente)
4º Passo: Calcular a concentração em quantidade de matéria da solução de MgCl2 (MF2) após a mistura.
M2.V2 = MF2.V2
0,09.600 = MF2.900
MF2 = 54
900MF2 = 0,06 mol/L(aproximadamente)
5º Passo: Calcular a quantidade de cátions magnésio na solução final.
Para isso, devemos multiplicar a concentração em quantidade de matéria de cada solução pelo número átomos magnésio em sua composição e, em seguida, somar:
[Mg+2] = 1.1,33 + 1.0,09
[Mg+2] = 1,33 + 0,09
[Mg+2] = 1,42 mol/L
-
-
Questão 2
Ao misturar 250 mL de solução aquosa 0,40 mol.L-1 de iodeto de lítio com 450 mL de solução aquosa 0,35 mol.L-1 de iodeto de bário, a solução resultante apresentará, respectivamente, as seguintes concentrações de Li+1, Ba+2 e I-1:
a) 0,143 mol.L-1, 0,225 mol.L-1, 0,593 mol.L-1
b) 0,243 mol.L-1, 0,3225 mol.L-1, 0,693 mol.L-1
c) 0,343 mol.L-1, 0,425 mol.L-1, 0,793 mol.L-1
d) 0,443 mol.L-1, 0,525 mol.L-1, 0,893 mol.L-1
e) 0,543 mol.L-1, 0,625 mol.L-1, 0,993 mol.L-1
Letra a). O exercício fornece os seguintes dados:
-
Volume de solução [LiI] = 250 mL
-
Concentração molar de solução [LiI] = 0,4 mol/L
-
Volume de solução [BaI2] = 450 mL
-
Concentração molar de solução [BaI2] = 0,35 mol/L
-
Volume final (VF) 700 mL (resultante da soma entre os volumes das soluções misturadas)
Para determinar a concentração, devemos seguir os seguintes passos:
1º Passo: Calcular a concentração em quantidade de matéria da solução de LiI (MF1) após a mistura.
M1.V1 = MF1.VF
0,4.250 = MF1.700
100 = MF1.700
MF1 = 100
700MF1 = 0,143 mol/L(aproximadamente)
2º Passo: Calcular a concentração em quantidade de matéria da solução de BaI2 (MF2) após a mistura.
M2.V2 = MF2.V2
0,35.450 = MF2.700
157,5 = MF2.700
MF2 = 157,5
700MF2 = 0,225 mol/L
3º Passo: Calcular a quantidade de cátions lítio na solução final.
Para isso, devemos multiplicar a concentração em quantidade de matéria de cada solução pelo número átomos de lítio em sua composição e, em seguida, somar:
[Li+1] = 1.0,143
[Li+1] = 0,143 mol/L
4º Passo: Calcular a quantidade de cátions bário na solução final.
Para isso, devemos multiplicar a concentração em quantidade de matéria de cada solução pelo número átomos de bário em sua composição, e em seguida somar:
[Ba+2] = 1.0,225
[Ba+2] = 0,225 mol/L
5º Passo: Calcular a quantidade de ânions iodeto (I-) na solução final.
Para isso, devemos multiplicar a concentração em quantidade de matéria de cada solução pelo número átomos de iodo em sua composição e, em seguida, somar:
[I-1] = 1.0,143 + 2.0,225
[I-1] = 0,143 + 0,45
[I-1] = 0,593 mol/L
-
-
Questão 3
(Ufam) A dois litros de solução aquosa sacarose de concentração 50 g/L foi adicionada 6 litros de concentração 2 mols/L de solução aquosa de cloreto de sódio. Qual a concentração do sal e do açúcar na solução final?
a) 25,0 g/L; 3,0 mol/L
b) 0,2 Kg/L; 3,0 mol/L
c) 12,5 g/L; 1,5 mol/L
d) 25,0 g/L; 1,5 mol/L
e) 12,5 g/L; 3,0 mol/L
Letra c). O exercício fornece os seguintes dados:
-
Volume de solução [sacarose] = 2 L
-
Concentração comum da solução de sacarose = 50 g/L
-
Volume de solução de cloreto de sódio = 6 L
-
Concentração em quantidade de matéria da solução do cloreto de sódio = 2 mol/L
-
Volume final (VF) 8 L (resultante da soma entre os volumes das soluções misturadas)
Para determinar a concentração de cátions magnésio na solução final, devemos realizar os seguintes passos:
1º Passo: Calcular a concentração em quantidade de matéria do cloreto de sódio (MF) após a mistura.
MC1.V1= MF.VF
2.6 = MF.8
12 = MF.8
MF=12
8MF = 1,5 mol/L
2º Passo: Calcular a concentração comum da solução de sacarose após a mistura.
C1.V1= CF.VF
50.2 = CF.8
100 = CF.8
CF=100
8CF = 12,5 g/L
-
-
Questão 4
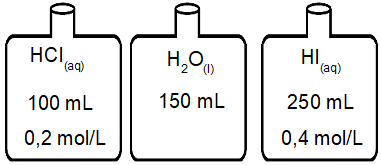
(Uerj) Para estudar os processos de diluição e mistura foram utilizados, inicialmente, três frascos contendo diferentes líquidos. A caracterização desses líquidos é apresentada na ilustração abaixo.
A seguir, todo o conteúdo de cada um dos frascos foi transferido para um único recipiente. Considerando a aditividade de volumes e a ionização total dos ácidos, a mistura final apresentou uma concentração de íons H+, em mol×L1, igual a:
a) 0,60
b) 0,36
c) 0,24
d) 0,12
Letra c). O exercício fornece os seguintes dados:
-
Volume de solução [HCl] =100 mL
-
Concentração molar de solução [HCl] = 0,2 mol/L
-
Volume de solução [HI] = 250 mL
-
Concentração molar de solução [HI] = 0,4 mol/L
-
Volume final (VF) 500 mL (resultante da soma entre os volumes das soluções misturadas)
Para determinar a concentração na solução final, devemos realizar os seguintes passos:
1º Passo: Calcular a concentração em quantidade de matéria da solução de HCl (MF1) após a mistura.
M1.V1 = MF1.VF
0,2.100 = MF1.500
20 = MF1.500
MF1 = 20
500MF1 = 0,04 mol/L (aproximadamente)
2º Passo: Calcular a concentração em quantidade de matéria da solução de HI (MF2) após a mistura.
M2.V2 = MF2.V2
0,4.250 = MF2.500
100 = MF2.100
MF2= 100
500MF2 = 0,2 mol/L
3º Passo: Calcular a quantidade de cátions H+ na solução final.
Para isso, devemos multiplicar a concentração em quantidade de matéria de cada solução pelo número átomos H+ em sua composição e, em seguida, somar:
[H+1] = 1.0,04 + 1.0,2
[H+1] = 0,04 + 0,2
[H+1] = 0,24 mol/L
-