Exercícios sobre número de oxidação (Nox)
Esta lista de exercícios aborda o cálculo do número de oxidação, também conhecido como NOX.
Publicado por: Stéfano Araújo NovaisQuestões
-
Questão 1
(Uerj 2º Exame de Qualificação/2024) Recentemente, a Marinha do Brasil afundou no mar um porta aviões deteriorado. Ambientalistas criticaram a operação, pois a estrutura do navio continha amianto, fibra mineral nociva à saúde.
O principal componente do amianto é a substância de fórmula química Mg3Si2O5(OH)4.
Nessa substância, o número de oxidação do silício é igual a:
A) −6
B) −4
C) +4
D) +6
Letra C.
O número de oxidação do silício pode ser calculado como:
3NOXMg + 2NOXSi + 5NOXO + 4NOXO + 4NOXH = 0
3(+2) + 2x + 9(−2) + 4(+1) = 0
+6 + 2x – 18 + 4 = 0
2x = +8
x = +4
-
Questão 2
(USS Univassouras Medicina/2023.2) Uma solução aquosa utilizada na desinfecção de frutas e verduras é formada a partir da reação entre cloro molecular e água, representada pela seguinte equação química:
Cl2 (g) + H2O (l) → HCl (aq) + HClO (aq)
Dentre os produtos formados nessa reação, o maior número de oxidação do cloro corresponde a:
A) +1
B) +2
C) +3
D) +4
Letra A.
No HCl, o número de oxidação do cloro é:
NOXH + NOXCl = 0
+1 + x = 0
x = −1
No HClO, o número de oxidação do cloro é:
NOXH + NOXCl + NOXO = 0
+1 + y + (–2) = 0
y = +1
Assim, o maior número de oxidação para o cloro entre os produtos formados é +1.
-
Questão 3
(UFSM Manhã/2023) Na década de 1960, período em que a agricultura somava desafios e tinha presença masculina como regra, a cientista Johanna Döbereiner foi uma exceção. Ao insistir no uso de microorganismos para promover a fixação biológica de nitrogênio e multiplicar a produtividade brasileira, alavancando a agricultura tropical e dando alento na busca por competitividade frente a grandes mercados, ela selou seu nome na história. Sua contribuição ajudou o Brasil a ser um grande produtor de soja, uma vez que a fixação biológica do nitrogênio desenvolveu-se no sentido inverso do que era praticado até então, com uso intensivo de adubos nitrogenados como fertilizantes minerais. Sua pesquisa contribuiu para a economia e sustentabilidade do Brasil, pois sua descoberta não poluía o solo e os rios.
Fonte: EMBRAPA. Portal embrapa. Johanna Döbereiner: a cientista que revolucionou a agricultura. Embrapa. [s.d]. Disponível em :https://www.embrapa.br/johanna-dobereiner/quem-foi. Acesso em: 28 maio 2023. (Adaptado)
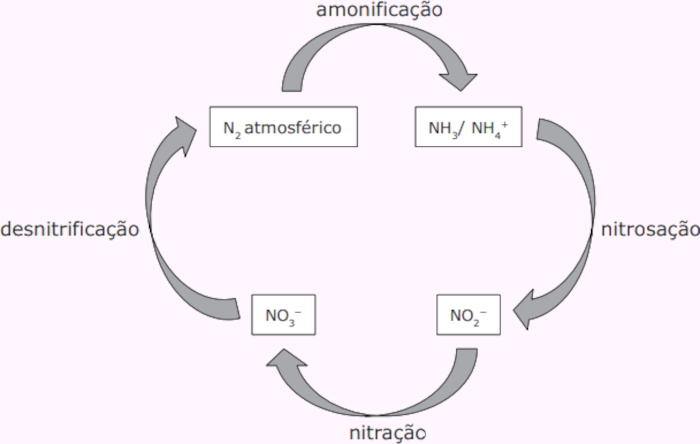
Pouco reativo do ponto de vista químico, apenas algumas bactérias têm a capacidade de fixar o nitrogênio atmosférico, convertendo-o numa forma que pode ser assimilado pelas plantas. O processo de fixação dessas espécies químicas ocorre em etapas, representadas na figura a seguir.
As espécies químicas amônia (NH3), nitrito (NO2−), nitrato (NO3−) e nitrogênio atmosférico (N2) são partes do ciclo do nitrogênio.
Assim sendo, é correto afirmar que os números de oxidação do nitrogênio na amônia, nitrito, nitrato e nitrogênio atmosférico são, respectivamente,
A) +3, –3, +5 e 0.
B) 0, +3, +4 e +6.
C) –3, +4, +6 e 0.
D) +3, +4, +3 e +6.
E) –3, +3, +5 e 0.
Letra E.
Número de oxidação do nitrogênio no NH3:
NOXN + 3NOXH = 0
x + 3(+1) = 0
x = −3
Número de oxidação do nitrogênio no NO2−:
NOXN + 2NOXO = −1
y + 2(−2) = −1
y = +3
Número de oxidação do nitrogênio no NO3−:
NOXN + 3NOXO = −1
z + 3(−2) = −1
z = +5
Número de oxidação do nitrogênio no N2: em se tratando de uma substância simples e neutra, o número de oxidação do nitrogênio é igual a 0.
-
Questão 4
(PUC-RJ Grupo 2/2019) Os números de oxidação do manganês, do cromo e do enxofre, nos compostos KMnO4, K2Cr2O7 e NaHSO3, respectivamente, são os seguintes:
A) +4, +6 e +6
B) +7, +6 e +4
C) +5, +2 e 0
D) +7, +3 e +4
E) +6, +6 e +6
Letra B.
NOX do Mn no KMnO4:
NOXK + NOXMn + 4NOXO = 0
+1 + x + 4(−2) = 0
x = +7
NOX do Cr no K2Cr2O7:
2NOXK + 2NOXCr + 7NOXO = 0
2(+1) + 2y + 7(−2) = 0
y = +6
NOX do S no NaHSO3:
NOXNa + NOXH + NOXS + 3NOXO = 0
+1 + 1 + z + 3(−2) = 0
x = +4
-
Questão 5
O peróxido de hidrogênio, H2O2, popularmente conhecido como água oxigenada, é um poderoso oxidante. Observe esse seu comportamento na reação com o sulfeto de sódio.
Na2S + 4 H2O2 → Na2SO4 + 4 H2O
Nesse processo, observa-se que o enxofre sofre a seguinte variação do seu número de oxidação:
A) de −1 para +4.
B) de −2 para +6.
C) de 0 para +4.
D) de −2 para 4.
E) de −1 para +6.
Letra B.
No sulfeto de sódio, o NOX do enxofre é calculado da seguinte forma:
2NOXNa + NOXS = 0
2(+1) + x = 0
x = −2
Já no sulfato de sódio, Na2SO4, o NOX do enxofre é calculado como:
2NOXNa + NOXS + 4NOXO = 0
2(+1) + x + 4(−2) = 0
+2 + x – 8 = 0
x = +6
-
Questão 6
Assinale a alternativa cujo átomo central apresenta número de oxidação igual a +5.
A) HClO
B) K2Cr2O7
C) K2CO3
D) H3PO4
E) H3BO3
Letra D.
O cálculo do número de oxidação do fósforo no H3PO4 é dado por:
3NOXH + NOXP + 4NOXO = 0
3(+1) + x + 4(−2) = 0
+3 + x – 8 = 0
x = +5
-
Questão 7
O cloro é um átomo que apresenta versatilidade quanto aos números de oxidação. Assim sendo, assinale a alternativa que contém os números de oxidação do cloro nas substâncias Cl2, KCl, HClO e NaClO4.
A) 0, −1, +1 e +7.
B) −1, −1, +1 e +3.
C) −2, −1, +1 e +3.
D) 0, −7, −1 e +7.
E) −1, −7, +3 e +7.
Letra A.
O Cl2 é uma substância covalente simples, assim sendo, neste caso, o NOX do cloro é igual a 0, pois o NOX de elementos em substância covalente simples é sempre zero.
KCl:
NOXK + NOXCl = 0
+1 + x = 0
x = −1
HClO:
NOXH + NOXCl + NOXO = 0
+1 + y + (–2) = 0
y = +1
NaClO4:
NOXNa + NOXCl + 4NOXO = 0
+1 + z + 4(−2) = 0
+1 + z – 8 = 0
z = +7
-
Questão 8
Elementos que têm número de oxidação fixo (ou invariável) costumam formar apenas uma única possibilidade de composto quando se ligam a outro átomo. Diferentemente dos elementos de número de oxidação variável, nos quais é possível formar, dentro de uma mesma classe de compostos, substâncias de atomicidade diferente.
Assim sendo, assinale a alternativa que contém o elemento que só consegue formar uma única possibilidade de óxido.
A) Fe
B) Cr
C) Mn
D) S
E) Ag
Letra E.
Para se ter uma única possibilidade de óxido, o elemento ligado ao oxigênio deve apresentar número de oxidação fixo. A prata, Ag, apresenta número de oxidação fixo, sempre +1. Assim, só existe um único óxido de prata, o Ag2O.
-
Questão 9
Nas estações de tratamento de água, uma das etapas correspondentes é a fluoretação, que consiste na adição de flúor à água tratada para conter os casos de cárie, assim, melhorando a saúde bucal da população de forma geral.
Uma das substâncias utilizadas para esse fim é o fluorossilicato de sódio, de fórmula Na2SiF6.
Assinale a alternativa que apresenta o número de oxidação do silício nessa substância.
A) 0
B) +1
C) +2
D) +4
E) +6
Letra D.
O NOX do silício nesse composto pode ser calculado como:
2NOXNa + NOXSi + 6NOXF = 0
2(+1) + x + 6(−1) = 0
+2 + x – 6 = 0
x = +4
-
Questão 10
O nitrato de potássio é muito empregado como fertilizante, uma vez que ele apresenta, na sua formulação, dois macronutrientes para as plantas: o potássio e o nitrogênio.
Sabendo que a fórmula do nitrato de potássio é KNO3, é possível dizer que o número de oxidação do nitrogênio nesse composto é igual a:
A) +1
B) +3
C) +5
D) +6
E) +7
Letra C.
O cálculo do número de oxidação do nitrogênio é dado por:
NOXK + NOXN + 3NOXO = 0
+1 + x + 3(−2) = 0
+1 + x – 6 = 0
x = +5
-
Questão 11
Para evitar os casos de bócio, a Organização Mundial da Saúde recomenda a iodação do sal de cozinha, principal tempero utilizado pelos seres humanos. Essa adição pode ser feita por meio da aplicação de sais de iodato, IO3−.
No ânion iodato, o número de oxidação do iodo é igual a:
A) –1
B) −3
C) −5
D) +3
E) +5
Letra E.
O NOX do iodo pode ser calculado da seguinte forma no ânion iodato:
NOXI + 3NOXO = −1
x + 3(−2) = −1
x – 6 = −1
x = +5
-
Questão 12
Para dissolução de metais nobres, que têm alta resistência ao ataque ácido e à oxidação, é comum a utilização de uma mistura de HNO3 e HCl, conhecida como aqua regia, que significa “água real”.
Ouro (Au) e platina (Pt), ao serem dissolvidos em aqua regia, formam os compostos HAuCl4 e H2PtCl6.
Assinale a alternativa que apresenta os números de oxidação de ouro e platina, respectivamente, nos compostos obtidos após a ação da aqua regia.
A) +3 e +6
B) +3 e +4
C) +2 e +4
D) +2 e +6
E) +1 e +3
Letra B.
NOX do ouro no HAuCl4:
NOXH + NOXAu + 4NOXCl = 0
+1 + x + 4(−1) = 0
x = +3
NOX da platina no H2PtCl6:
2NOXH + NOXPt + 6NOXCl = 0
2(+1) + y + 6(−1) = 0
+2 + y – 6 = 0
y = +4