Exercícios sobre os cicloalcanos
Os cicloalcanos são hidrocarbonetos cíclicos (de cadeia fechada) saturados (possuem somente ligações simples entre os átomos de carbono).
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
A fórmula molecular de um cicloalcano com oito átomos de carbono é:
-
C8H8
-
C8H14
-
C8H16
-
C8H18
-
C8H24
Alternativa “c”.
Visto que a fórmula geral dos cicloalcanos é: CnH2n, e n = 8, então, temos que a fórmula desse composto é: C8H16.
-
-
Questão 2
Abaixo temos a estrutura de um cicloalcano denominado adamantano. Sobre ele, qual das afirmativas abaixo está incorreta?
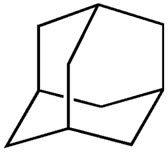
-
Possui átomos de carbono secundários.
-
Possui átomos de carbono terciários.
-
Possui ligações pi.
-
É um hidrocarboneto saturado policíclico.
-
Sua fórmula molecular é C10H16.
Alternativa “c”.
a) e b) estão corretas conforme mostrado na figura abaixo:
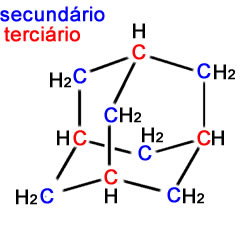
c) Como ele é um cicloalcano, existem somente ligações simples entre seus átomos de carbono.
d) É um hidrocarboneto (possui somente átomos de carbono e hidrogênio), saturado (possui somente ligações simples entre carbonos) e policíclico (possui mais de um ciclo).
e) Como se pode notar pela imagem acima, a sua fórmula é realmente C10H16.
-
-
Questão 3
(PUC-MG) Um mol de um hidrocarboneto de fórmula desconhecida consome, em combustão total, 134,4 L de O2 medidos em CNTP e produz 72 g de H2O. É correto concluir que o composto orgânico é o:
-
Propano.
-
Butano.
-
Ciclobutano.
-
Ciclopropano.
-
Propeno.
Alternativa “c”
Com os dados mencionados no enunciado, sabemos que foi 1 mol do hidrocarboneto que reagiu. Visto que nas CNTP 1 mol equivale a 22,4 L, podemos descobrir a quantidade de matéria de oxigênio que reagiu:
22,4 L – 1 mol
134,4 L --- X
X = 6 mol de O2Podemos também descobrir a quantidade de matéria de água que foi produzida:
1 mol ------- 18 g
y------------- 72 g
y = 4 mol de H2OVisto que toda reação de combustão completa de hidrocarbonetos gera x CO2 + 4 H2O, resta descobrir somente o coeficiente do CO2 na equação química, que pode ser facilmente conseguido por um balanceamento simples. Se o balanceamento não estiver correto, sabemos que não é nossa reação, pois não segue a proporção estequiométrica.
Veja isso para cada caso:
- 1 C3H8 + 6 O2 → CO2 + 4 H2O
Não é possível realizar esse balanceamento porque, no primeiro membro, temos 3 átomos de carbono e se colocarmos o coeficiente 3 no CO2, a quantidade de oxigênio nos dois membros será diferente.
- 1 C4H10 + 6 O2 → CO2 + 4 H2O
Nesse caso, não é possível nem realizar o balanceamento, pois no primeiro membro existem 10 átomos de hidrogênio, sendo que no segundo temos apenas 8.
- 1 C4H8 + 6 O2 → 4 CO2 + 4 H2O
56 g 192g 176g 72g
248 248
Essa é a reação correta.
- 1 C3H6 + 6 O2 → CO2 + 4 H2O
Não é possível realizar o balanceamento, pois no primeiro membro existem 10 átomos de hidrogênio, sendo que no segundo há apenas 8.
- Mesma fórmula molecular no item anterior.
-
-
Questão 4
(Unip-SP) O composto que reage mais facilmente com hidrogênio é:
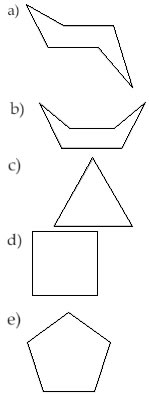
Alternativa “c”.
O ciclo mais reativo é o menos estável, ou seja, o ciclo com 3 carbonos.
-
Questão 5
(UFC-CE) A estabilidade dos cicloalcanos cresce na seguinte ordem: ciclopropano < ciclobutano < ciclopentano. Assinale a alternativa que explica esta diferença de estabilidade.
a) Índice de octanos.
b) Regra de Saytzeff.
c) Força de van der Waals.
d) Teoria da tensão dos anéis.
e) Energia de ligação dos átomos.
Alternativa “d”.
A teoria da tensão dos anéis de Baeyer para os ciclanos, estabelecida em 1885, pode ser resumida no seguinte ponto: “Quanto maior a tensão entre os ângulos de ligação dos carbonos na molécula, ou seja, quanto mais os ângulos se afastarem de 109° 28', mais instável será o ciclano. Já quanto mais os ângulos entre as ligações dos carbonos se aproximarem de 109° 28', menor será a tensão e o ciclano será mais estável”.
-
Questão 6
Questão 6:
Qual dos ciclanos abaixo apresenta 6 átomos de carbono na molécula, sendo dois terciários:
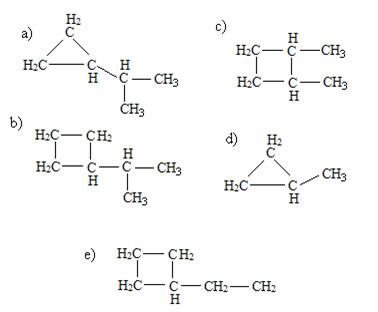
Alternativa “a”.