Exercícios sobre proteção contra corrosão dos metais
Estes exercícios sobre proteção contra corrosão dos metais envolvem processos como a galvanização com uso de metais de sacrifício e revestimentos.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(UFPR) A corrosão dos metais é um processo de considerável importância econômica porque diminui a vida útil dos produtos metálicos, cuja substituição é de custo elevado.
Durante o processo de corrosão, os metais sofrem oxidação. O ferro, por exemplo, oxida-se, resultando na ferrugem (Fe2O3.H2O). A transformação de ferro metálico em ferrugem só ocorrerá na presença de um agente oxidante. As semirreações a seguir estão envolvidas no processo de corrosão do ferro.
I – Fe3+(aq) + 3 e- → Fe(s) E0 = - 0,04 V
II – 2 H2O(líq) + 2 e- → H2(g) + 2 OH-(aq) E0 = - 0,41 V
III – O2(g) + 4 H+(aq) + 4 e- → 2 H2O(líq) E0 = +0,82 VUma maneira simples de prevenir a corrosão consiste em proteger a superfície metálica pela pintura. Outra forma de proteção é a galvanização, que consiste na aplicação de uma camada de zinco à superfície do ferro. Grandes estruturas podem ser protegidas pela sua conexão a um bloco de zinco ou magnésio (ver figura abaixo, em que M representa Mg ou Zn).
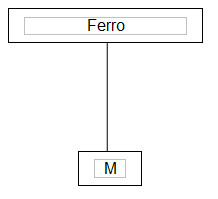
Figura em exercício mostrando proteção de ferro com conecção a blocos de zinco ou magnésioConforme o caso, as semirreações envolvidas são:
IV – Zn2+(aq) + 2 e- → Zn(s) E0 = - 0,76 V
V – Mg2+(aq) + 2 e- → Mg(s) E0 = - 2,36 VCom base no texto acima, é correto afirmar sobre o processo de corrosão do ferro:
1. As semirreações I e II indicam que uma película de água pura sobre a superfície do ferro é um poderoso oxidante desse metal, resultando na ferrugem.
2. A semirreação III revela que o gás oxigênio favorece o processo de corrosão.
3. Uma película de tinta previne a corrosão por impedir o contato do metal com o agente oxidante.
4. Na galvanização, o zinco protege o ferro por ceder elétrons mais facilmente que este último.
5. O zinco é um melhor redutor que o magnésio.
Apenas a 5 está incorreta.
1. Correto. A semirreações de oxidação, redução e reação global são, respectivamente:
Fe(s) → Fe3+(aq) + 3 e-
2 H2O(l) + 2 e- → H2(g) + 2 OH-(aq)
2 Fe(s) + 6 H2O(l) → 2 Fe3+(aq) + 3 H2(g) + 6 OH-(aq)∆E = (-0,04) - (-0,41)
∆E = +0,37 V (reação espontânea)2. Correto. Como E0 red III > E0 red I, o gás oxigênio sofre redução, enquanto o ferro metálico oxida-se, ou seja, sofre corrosão.
3. Correto. Ao pintar a superfície do ferro metálico, o contato dessa superfície limita-se à tinta, o que previne o contato com agentes oxidantes e, consequetemente, a corrosão.
4. Correto. O zinco apresenta menor potencial de redução que o ferro. Assim, o zinco sofre oxidação no lugar do ferro, agindo como um metal de sacrifício.
5. Incorreto. Como E0 red Mg > E0 red Zn, o zinco é melhor oxidante que o magnésio.
-
Questão 2
(UNI-RIO) "A ferrugem" apresentada pelos automóveis, na nossa cidade, é um processo denominado corrosão. Na presença de ar seco (ausência de umidade), o automóvel praticamente não enferruja. Numa cidade praiana, como o Rio de Janeiro, torna-se necessária a adoção de medidas que minimizem a corrosão. Uma delas é a galvanização, que significa revestir o ferro presente no automóvel com um metal redutor mais forte do que ele. Assinale a opção que apresenta o metal redutor que permite a galvanização do ferro.
(Dado: Fe2+/Fe = - 0,44V)
a) Cd2+(aq) + 2e- → Cd(s) E0 (V) = - 0,40
b) Co2+(aq) + 2e- → Co(s) E0 (V) = -0,28
c) Cu2+(aq) + 2e- → Cu(s) E0 (V) = 0,34
d) Ni2+(aq) + 2e- → Ni(s) E0 (V) = -0,25
e) Zn2+(aq) + 2e- → Zn(s) E0 (V) = -0,76Alternativa “e”.
O zinco é o único dos metais apresentados que possui potencial de redução (-0,76 V) menor que o do ferro (-0,44 V). Assim, o zinco oxida-se no lugar do ferro, agindo como um metal de sacrifício em um processo de galvanização.
-
Questão 3
O alumínio sofre corrosão em contato com o ferro. Para efetuar uma proteção catódica, qual dos metais a seguir é o mais indicado? E qual é a equação química correspondente?
Dados:
Al3+(aq) + 3 e- → Al(s) E0 = -1,67 V
Zn2+(aq) + 2 e- → Zn(s) E0 = - 0,76 V
Cu2+(aq) + 2 e- → Cu(s) E0 = +0,34 V
Mg2+(aq) + 2 e- → Mg(s) E0 = - 2,38 V
Ni2+(aq) + 2e- → Ni(s) E0 = -0,25 Va) Alumínio. Equação: Fe + Al3+→ Fe3+ + Al
b) Zinco. Equação: 3 Zn + 2 Al3+→ 3 Zn2+ + 2 Al
c) Cobre. Equação:3 Cu + 2 Al3+→ 3 Cu2+ + 2 Al
d) Magnésio. Equação:3 Mg + 2 Al3+→ 3 Mg2+ + 2 Al
e) Níquel. Equação: 3 Ni + 2 Al3+→ 3 Ni2+ + 2 Al
Alternativa “d”.
O metal mais indicado é o de maior potencial de oxidação (ou menor potencial de redução), ou seja, o Magnésio.
A equação química é dada por:
3 Mg + 2 Al3+→ 3 Mg2+ + 2 Al
-
Questão 4
Uma forma de proteger um metal contra corrosão é conectá-lo eletricamente a um ânodo de sacrifício. Este deve ser:
a) um metal mais facilmente oxidável do que o metal que se quer proteger.
b) um metal menos facilmente oxidável do que o metal que se quer proteger.
c) o mesmo metal que se quer proteger.
d) uma pintura.
e) um metal com potencial de redução maior do que o do metal que se quer proteger.
Alternativa “a”.
