Exercícios sobre a química dos sabões e detergentes
Estes exercícios abordam as características e particularidades da química dos sabões e detergentes, como a ação de limpeza e as alterações em propriedades da água.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Um estudante resolve preparar em casa uma mistura proposta pelo seu professor de Química. Em um recipiente, ele adiciona uma certa quantidade de água, algumas colheres de sopa de óleo de soja e algumas gotas de um detergente. Sobre esse procedimento, é correto afirmar que, após a agitação da mistura:
a) ela torna-se bifásica.
b) ela tona-se monofásica, pelo fato de o detergente interagir tanto com o óleo quanto com a água.
c) resulta em uma solução supersaturada.
d) o detergente funciona como um catalisador no procedimento.
e) há reação química entre o detergente e o óleo.
Letra b). As outras alternativas estão incorretas porque:
a) A adição do detergente favorece a solubilização do óleo na água, formando um sistema monofásico.
c) Solução supersaturada é formada a partir de aquecimento e resfriamento de uma solução saturada com corpo de fundo. O que não é o caso apresentado pelo exercício.
d) Catalisadores elevam a velocidade de uma reação química. No caso do exercício, não ocorre reação entre os componentes que foram misturados, mas solubilização.
e) Entre o óleo e o detergente ocorre uma interação física, denominada interação de Van Der Waals.
-
Questão 2
Os sabões são utilizados para facilitar a remoção de partículas de gordura ou óleo presentes nos utensílios domésticos. Um exemplo de substância presente em sabões ou detergentes é o dodecanoato de sódio (estrutura representada abaixo), o qual pertence à função oxigenada sal de ácido carboxílico.
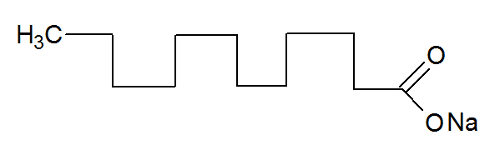
Podemos afirmar que a ação de limpeza realizada pelo sabão ou detergente ocorre devido:
a) à interação de van der Waals da parte apolar e à ligação de hidrogênio da parte polar de sua molécula, respectivamente, com a gordura e a água.
b) ao aumento do pH do meio, fazendo com que a gordura dissolva-se na água.
c) a uma diminuição da densidade da água, fazendo com que as partículas de gordura depositem-se no fundo do recipiente.
d) a uma elevação na tensão superficial da água, favorecendo a formação de uma espuma em sua superfície.
Letra a). As outras alternativas estão incorretas porque:
b) Não ocorre a alteração do pH por não liberar ou interagir com íons hidrônio (H+) e hidróxido (OH-) no meio.
c) Há um aumento da densidade da água, já que as moléculas de detergente e gordura passam a fazer parte do meio.
d) A utilização do detergente diminui a tensão superficial da água por causa da interação da parte polar do detergente com a água, e da parte apolar do detergente com a gordura ou óleo.
-
Questão 3
(Acafe-SC) No jornal Folha de São Paulo, de 23 de junho de 2015, foi publicada uma reportagem sobre a formação de espuma branca no rio Tietê ´´[…] a formação de espuma está associada à baixa vazão da água e à presença de esgoto doméstico não tratado. A falta de oxigênio na água dificulta a degradação de detergente doméstico […]”.
Baseado nas informações fornecidas e nos conceitos químicos, analise as afirmações a seguir.
I. O detergente é uma substância anfipática.
II. O complexo formado entre detergente, óleo e água pode ser chamado de micela.
III. O oxigênio é uma molécula apolar formada por uma ligação covalente do tipo sigma (σ) e outra do tipo pi (π).
IV. A espuma branca formada pode ser classificada de coloide.
Assinale a alternativa correta:
a) Apenas I, II e III estão corretas.
b) Apenas II, III e IV estão corretas.
c) Todas as afirmações estão corretas.
d) Apenas a afirmação IV está correta.
Letra c). As alternativas estão corretas porque:
I- Verdadeiro, já que ele apresenta uma parte polar e outra apolar.
II- Verdadeiro, já que micela é uma estrutura formada a partir da interação da parte polar do detergente com a água, e da parte apolar do detergente com a gordura.
III- A molécula do oxigênio (O2) possui apenas dois átomos desse elemento, caracterizando, assim, uma molécula apolar por ser diatômica formada por átomos iguais, que interage por uma ligação dupla, ou seja, uma ligação sigma e outra pi.
IV- Toda espuma é um coloide.
-
Questão 4
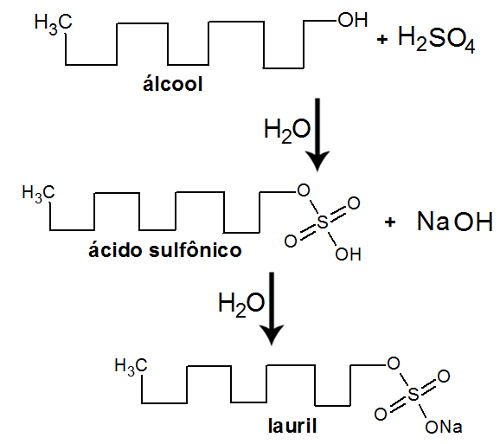
(FCM-MG) Sabões são sais de ácidos graxos, como o estearato de sódio – C17H35COONa –, ao passo que detergentes são sais de sódio de alcoóis sulfatados de longa cadeia, como o lauril sulfato de sódio (C11H23CH2OSO3Na). A água dura, que contém cátions cálcio e magnésio, reage com o sabão, formando sabões insolúveis. Entretanto, forma sais solúveis com os detergentes. Analisando essas informações e utilizando seus conhecimentos, não podemos afirmar que:
a) detergentes e sabões contêm uma parte polar (hidrófila) e uma parte apolar (hidrofóbica).
b) em água dura, há necessidade de mais sabão para se produzir espuma que em água de menor dureza.
c) estearato de sódio é um sabão proveniente da saponificação de um óleo, ou seja, de um ácido graxo insaturado.
d) lauril sulfato de sódio pode ser preparado a partir de um álcool de 12 carbonos com ácido sulfúrico, seguido de uma neutralização com hidróxido de sódio.
Letra c). A alternativa está incorreta porque o esterato de sódio não é um composto insaturado, mas saturado, conforme a estrutura formada a partir da fórmula estrutural fornecida:
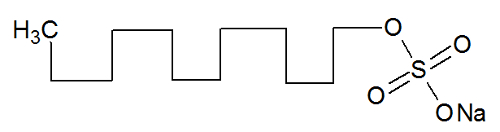
As outras alternativas estão corretas porque:
a) Os sabões e detergentes apresentam uma parte capaz de interagir com a água e outra parte capaz de interagir com óleos e gorduras.
b) A formação de espumas em água dura é menor pela maior quantidade de íons presentes na água, os quais interagem com as moléculas do sabão ou detergente, formando compostos insolúveis.
d) O álcool com 12 carbonos reage com o ácido sulfúrico, formando água e um ácido sulfônico. Quando esse ácido sulfônico interage com o hidróxido de sódio, forma-se uma nova molécula de água e o lauril.