Exercícios sobre reações de decomposição
Estes exercícios sobre reações de decomposição ou análise envolvem a formação de dois ou mais produtos a partir de um reagente.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(FEI-SP) Das reações químicas que ocorrem:
I. nos flashes fotográficos descartáveis;
II. com o fermento químico para fazer bolos;
III. no ataque de ácido clorídrico ao ferro;
IV. na formação de hidróxido de alumínio usado no tratamento de água;
V. na câmara de gás;
representadas, respectivamente, pelas equações:
I. 2 Mg + O2 →2 MgO
II. NH4HCO3 → CO2+ NH3 + H2O
III. Fe + 2 HCℓ → FeCℓ2+ H2
IV. Aℓ2(SO4)3+ 6 NaOH → 2 Aℓ(OH)3+ 3 Na2SO4
V. H2SO4+ 2 KCN → K2SO4 + 2 HCN
Assinale a alternativa que corresponde a reações de decomposição:
a) apenas I e III.
b) apenas II e IV.
c) apenas I.
d) apenas II.
e) apenas V.
Alternativa “d”.
Somente a reação II é de decomposição, pois nela uma substância (NH4HCO3) decompõe-se em três substâncias mais simples (CO2+ NH3 + H2O). O bolo cresce em razão da liberação do gás carbônico (CO2).
-
Questão 2
(Fuvest-SP) A decomposição térmica por aquecimento gradual e contínuo (ao ar) do acetato de manganês (II) tetraidratado, sólido, ocorre em duas etapas:
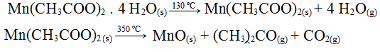
Reações de decomposição térmica do acetato de manganês (II) tetraidratadoCerta massa do sal hidratado é aquecida nessas condições. Qual dos gráficos abaixo representa o que ocorre com a massa (m) da fase sólida com o aumento da temperatura (t)?
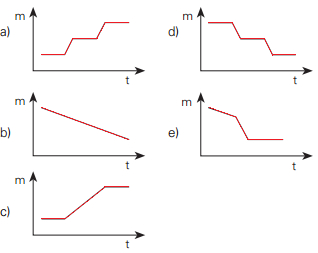
Alternativas com gráficos de possível decomposição térmicaAlternativa “d”.
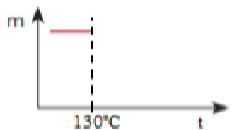
Fazendo o aquecimento gradual do sal hidratado, a temperatura permanece constante em 130ºC até começar a desidratação:
Primeira parte de construção de gráfico em resposta de exercício sobre decomposição térmica gradualA massa do sal diminui até que ocorra a sua desidratação total:
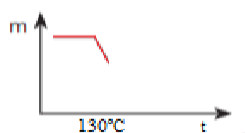
Segunda parte de construção de gráfico de resposta em exercício sobre decomposição térmica gradualA temperatura permanece constante em 350ºC quando começa a decomposição do sólido anidro:
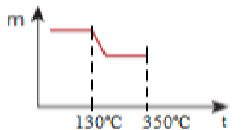
Terceira parte de construção de gráfico de resposta em exercício sobre decomposição térmica gradualA massa diminui até restar somente o MnO:
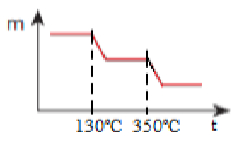
Resposta de exercício sobre decomposição térmica gradual -
Questão 3
Observe a seguir alguns exemplos de diferentes tipos de reações de análise ou decomposição:
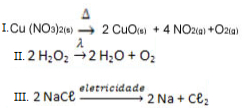
Exemplos de reações inorgânicas de decomposiçãoIndique o nome específico dado para essas reações inorgânicas, respectivamente:
a) térmica, síntese, eletrólise.
b) adição, fotólise, pirólise.
c) pirólise, fotólise, eletrólise.
d) fotólise, pirólise, eletrólise.
e) dupla troca, simples troca, eletrólise.
Alternativa “c”.
I. Pirólise é a decomposição pelo calor;
II. Fotólise é a decomposição pela luz
III. Eletrólise é a decomposição pela eletricidade.
-
Questão 4
Assinale a única alternativa que indica uma reação de decomposição:
a) 2 HgO → 2 Hg + O2
b) HBr + KOH → KBr + H2O
c) CaO + H2O → Ca(OH)2
d) 2 Na + ZnCl2 → NaCl + Zn
e) 3 H2 + N2 → 2 NH3
Alternativa “a”.
A reação “a” é de decomposição porque nela uma substância (HgO) decompõe-se em duas substâncias mais simples (Hg + O2).