Exercícios sobre reagente em excesso e sobre reagente limitante
Resolva esta lista de exercícios sobre reagente em excesso e sobre reagente limitante, casos muito importantes dos cálculos estequiométricos.
Publicado por: Stéfano Araújo NovaisQuestões
-
Questão 1
(UFT) Quando misturamos soluções aquosas de nitrato de chumbo, Pb(NO3)2, com iodeto de césio, CsI, forma-se o nitrato de césio, CsNO3, e o precipitado de coloração amarela de iodeto de chumbo, PbI2, conforme a reação:
Pb(NO3)2 (aq) + 2 CsI (aq) → PbI2 (s) + 2 CsNO3 (aq)
Massas molares (g/mol): Pb = 207; N = 14; O = 16; Cs = 133; I = 127.
Considerando-se os dados de massa molares fornecidos, se forem misturados 3,31 g de Pb(NO3)2 e 2,6 g de CsI, o valor aproximado da massa, em gramas, de PbI2 obtida na reação é:
A) 1,93 g
B) 2,30 g
C) 4,61 g
D) 5,67 g
Alternativa B.
Pela equação química, 1 mol de Pb(NO3)2 necessita de 2 mols de CsI para a ocorrência da reação.
Com as massas indicadas, aferimos o número de mols (n) dos reagentes pela fórmula n = m/MM, em que m é a massa e MM é a massa molar.
Para o Pb(NO3)2 → n = 3,31 g/331 g/mol; n = 0,01 mol.
Para o CsI → n = 2,6 g/260 g/mol; n = 0,01 mol.
Dessa forma, percebe-se que se 1 mol de Pb(NO3)2 precisa de 2 mols de CsI, proporcionalmente 0,01 mol de Pb(NO3)2 necessita de 0,02 mol de CsI. Contudo, apenas 0,01 mol de CsI está presente, indicando que esse se trata do reagente limitante.
Com a quantidade do reagente limitante, determinamos a quantidade de PbI2 produzida:
2 mols CsI -------------- 1 mol PbI2
0,01 mol CsI ---------- x
Assim, pela regra de 3, x é igual a 0,005 mol.
A massa de 0,005 mol de PbI2 também é determinada pela fórmula n = m/MM:
n = m/MM
m = n ∙ MM
m = 0,005 mol ∙ 461 g/mol
m = 2,305 g de PbI2
-
Questão 2
(PUC) A reação de combustão completa do gás metano é representada pela equação não balanceada:
CH4 + O2 → CO2 + H2O
Se colocarmos para reagir 32 g de CH4 e 130 g de O2, a massa de água (máxima) produzida será de:
A) 18 g.
B) 36 g.
C) 72 g.
D) 144 g.
Alternativa C.
A reação balanceada é:
CH4 + 2 O2 → CO2 + 2 H2O
Assim, para cada 1 mol de CH4, são necessários 2 mols de O2.
Com as massas indicadas, aferimos o número de mols (n) dos reagentes pela fórmula n = m/MM, em que m é a massa e MM é a massa molar.
Para o CH4 → n = 32 g/16 g/mol; n = 2 mols.
Para o O2 → n = 130 g/32 g/mol; n = 4,0625 mols.
Dessa forma, percebe-se que se 1 mol de CH4 precisa de 2 mols de O2, proporcionalmente 2 mols de CH4 necessitam de 4 mols de O2. Contudo, o número de mols de O2 presente excede os 4 mols necessários e, portanto, esse reagente está em excesso, enquanto CH4 é o reagente limitante.
Com a quantidade do reagente limitante, determinamos a quantidade de água produzida:
1 mol CH4 -------------- 2 mols H2O
2 mols CH4 ---------- x
Assim, pela regra de 3, x é igual a 4 mols.
A massa de 4 mols água também é determinada pela fórmula n = m/MM:
n = m/MM
m = n ∙ MM
m = 4 mols ∙ 18 g/mol
m = 72 g de H2O
-
Questão 3
(Uerj) O ácido iodídrico, utilizado na higienização de instrumentos médicos, dentre outras aplicações, é produzido a partir da seguinte reação química:
2 I2 + N2H4 → 4 HI + N2
Em um processo de produção industrial, ao adicionar 254 kg de I2 e 80 kg de N2H4, verifica-se o consumo completo do reagente limitante.
A massa de reagente em excesso, que não foi consumida, em quilogramas, tem valor igual a:
A) 16
B) 32
C) 64
D) 72
Alternativa C.
Com as massas indicadas, aferimos o número de mols (n) dos reagentes pela fórmula n = m/MM, em que m é a massa e MM é a massa molar.
Para o I2 → n = 254 ∙ 103 g/254 g/mol; n = 1 ∙ 103 mols.
Para o N2H4 → n = 80 ∙ 103 g/32 g/mol; n = 2,5 ∙ 103 mols.
Dessa forma, percebe-se que se 2 mols de I2 precisam de 1 mol de N2H4, proporcionalmente 1000 mols de I2 necessitam de 500 mols de N2H4. Contudo, o número de mols de N2H4 presente excede os 500 mols necessários e, portanto, esse reagente está em excesso. O número de mols em excesso de N2H4 é igual à quantidade presente, decrescida da quantidade que de fato reage com os 1000 mols de I2, ou seja, 2500 – 500, igual a 2000 mols.
A massa de 2000 mols N2H4 também é determinada pela fórmula n = m/MM:
n = m/MM
m = n ∙ MM
m = 2000 mols ∙ 32 g/mol
m = 64000 g de N2H4
m = 64 kg de N2H4.
-
Questão 4
(Enem) Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio(I) que não foram utilizados em uma aula prática. Cada frasco continha 5,25 g de Hg2(NO3)2 dissolvidos em água. Temendo a toxidez do mercúrio e sabendo que o Hg2Cl2 tem solubilidade muito baixa, o assistente optou por retirar o mercúrio da solução por precipitação com cloreto de sódio (NaCl), conforme a equação química:
Hg2(NO3)2 (aq) + 2 NaCl (aq) → Hg2Cl2 (s) + 2 NaNO3 (aq)
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.
Frasco
I
II
III
IV
V
VI
VII
Massa de NaCl em grama (g)
0,2
0,4
0,6
0,8
1,0
1,2
1,4
O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. O assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCl adicionada com a massa de Hg2Cl2 obtida em cada frasco. A massa molar do Hg2(NO3)2 é 525 g∙mol–1, a do NaCl é 58 g∙mol–1 e a do Hg2Cl2 é 472 g∙mol–1.
Qual foi o gráfico obtido pelo assistente de laboratório?
A)
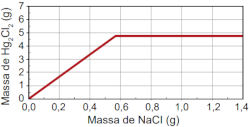
B)

C)
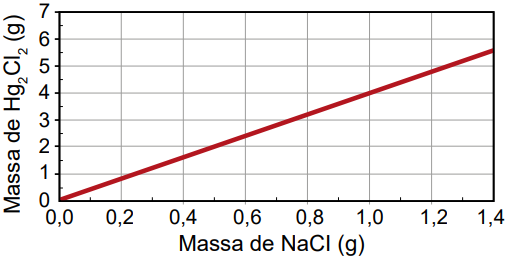
D)
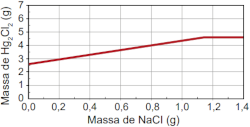
E)
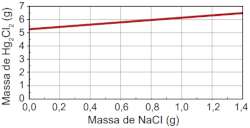
Alternativa B.
Pela fórmula n = m/MM, em que n é o número de mols, m é a massa da substância e MM é a massa molar da mesma substância, podemos chegar ao número de mols de Hg2(NO3)2:
n = m/MM
n = 5,25 g/ 525 g/mol → n = 0,01 mol de Hg2(NO3)2
Pela reação balanceada, percebe-se que cada 1 mol de nitrato de mercúrio (I) necessita de 2 mols de NaCl. Proporcionalmente, 0,01 mol de nitrato de mercúrio (I) necessita de 0,02 mol de NaCl.
Assim, a quantidade de Hg2(NO3)2 presente só é capaz de reagir com até 0,02 mol de NaCl, que, em termos de massa, é igual a:
n = m/MM
m = n ∙ MM
m = 0,02 mol ∙ 58 g/mol
m = 1,16 g de NaCl
Por isso, qualquer quantidade acima disso configura um excesso de NaCl, não aumentando a quantidade de Hg2Cl2 produzida. Com isso, a partir do frasco VI, não haverá aumento na quantidade de Hg2Cl2 produzida, ficando a massa desse composto constante, independentemente da quantidade de NaCl adicionada.
O gráfico que representa esse comportamento é o da alternativa B. Ele inicia em 0 g por 0 g, pois, na ausência de um reagente, não há como haver produção de determinado produto.
-
Questão 5
A formação do hipoclorito de sódio, importante produto na fabricação de alvejantes e desinfetantes, pode ser obtida por meio do seguinte processo químico:
Cl2 + 2 NaOH → NaClO + NaCl + H2O
A máxima massa de hipoclorito de sódio, em kg, que pode ser formada quando 142 kg de gás cloro reagem com 200 kg de NaOH é igual a:
A) 74,5 kg
B) 111,75 kg
C) 149,0 kg
D) 186,25 kg
E) 223,5 kg
Alternativa C.
Com as massas indicadas, aferimos o número de mols (n) dos reagentes pela fórmula n = m/MM, em que m é a massa e MM é a massa molar.
Para o Cl2 → n = 142 ∙ 103 g/71 g/mol; n = 2 ∙ 103 mol.
Para o NaOH → n = 200 ∙ 103 g/40 g/mol; n = 5 ∙ 103 mol.
Pela reação, percebe-se que se 1 mol de Cl2 precisa de 2 mols de NaOH, proporcionalmente 2 ∙ 103 mols de Cl2 necessitam de 4 ∙ 103 mols de NaOH. Contudo, vê-se que há 5 ∙103 mols de NaOH, ou seja, além do necessário para a reação completa. Por conta disso, o NaOH é o reagente em excesso e o Cl2 é o reagente limitante.
Com a quantidade do reagente limitante, determinamos a quantidade de NaClO produzida:
1 mol Cl2 -------------- 1 mol NaClO
2 ∙ 103 mols Cl2 ---------- x
Assim, pela regra de 3, x é igual a 2 ∙ 103 mols.
A massa de 2 ∙ 103 mols de NaClO também é determinado pela fórmula n = m/MM:
n = m/MM
m = n ∙ MM
m = 2 ∙ 103 mol ∙ 74,5 g/mol
m = 149 ∙ 103 g de NaClO
m = 149 kg de NaClO
-
Questão 6
O hidrogênio molecular é um combustível de alto poder energético. Além disso, é ambientalmente vantajoso, uma vez que o único produto da sua combustão é a água, conforme a reação descrita a seguir.
H2 (g) + ½ O2 (g) → H2O (g)
Determine a massa de água formada, em gramas, quando fazemos a combustão de 112 L de H2, nas CNTP, com o mesmo volume de gás oxigênio, também nas CNTP.
A) 18 g.
B) 36 g.
C) 54 g.
D) 72 g.
E) 90 g.
Alternativa E.
Com os volumes indicados, aferimos o número de mols (n) dos reagentes pela fórmula n = V/VM, em que V é o volume da substância e VM é o volume molar, que nas CNTP é igual a 22,4 L/mol.
Para o H2 → n = 112 L/22,4 L/mol; n = 5 mols.
Para o O2 → n = 112 L/22,4 L/mol; n = 5 mols.
Pela reação, percebe-se que 1 mol de H2 precisa de 0,5 mol de O2. Proporcionalmente, 5 mols de H2 necessitam de 2,5 mols de O2. Contudo, vê-se que há 5 mols de O2, ou seja, além do necessário para a reação completa. Por conta disso, o O2 é o reagente em excesso e o H2 é o reagente limitante.
Com a quantidade do reagente limitante, determinamos a quantidade de água produzida:
1 mol H2 -------------- 1 mol H2O
5 mols H2 ---------- x
Assim, pela regra de 3, x é igual a 5 mols de H2O.
A massa de 5 mols de H2O pode ser determina pela fórmula n = m/MM, em que n é o número de mols, m é a massa da substância e MM é a massa molar da mesma substância.
n = m/MM
m = n ∙ MM
m = 5 mol ∙ 18 g/mol
m = 90 g de H2O
-
Questão 7
A produção de amônia, NH3, é de extrema importância para a agricultura. Industrialmente, tal produto é obtido por meio de um processo conhecido como Haber-Bosch, cuja reação química é a que se segue:
N2 (g) + 3 H2 (g) → 2 NH3 (g)
Se em um reator forem misturados 280 kg de N2 com 200 kg de H2, a máxima massa de amônia produzida, em kg, é igual a, aproximadamente:
A) 340 kg.
B) 420 kg.
C) 680 kg.
D) 840 kg.
E) 1020 kg.
Alternativa A.
Com as massas indicadas, aferimos o número de mols (n) dos reagentes pela fórmula n = m/MM, em que m é a massa e MM é a massa molar.
Para o N2 → n = 280 ∙ 103 g/28 g/mol; n = 1 ∙ 104 mol.
Para o H2 → n = 200 ∙ 103 g/2 g/mol; n = 1 ∙ 105 mol.
Pela reação, percebe-se que se 1 mol de N2 precisa de 3 mols de H2, proporcionalmente 1 ∙ 104 mols de N2 necessitam de 3 ∙ 104 mols de H2. Contudo, vê-se que há 1 ∙ 105 mols de H2, ou seja, além do necessário para a reação completa. Por conta disso, o H2 é o reagente em excesso e o N2 é o reagente limitante.
Com a quantidade do reagente limitante, determinamos a quantidade de NH3 produzida:
1 mol N2 -------------- 2 mols NH3
1 ∙ 104 mols N2 ---------- x
Assim, pela regra de 3, x é igual a 2 ∙ 104 mols.
A massa de 2 ∙ 104 mols de NH3 também é determinada pela fórmula n = m/MM:
n = m/MM
m = n ∙ MM
m = 2 ∙ 104 mol ∙ 17 g/mol
m = 34 ∙ 104 g de NH3
m = 340 kg de NH3
-
Questão 8
A neutralização consiste em uma reação entre um ácido e uma base. Um exemplo é a reação que se segue:
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O
Caso sejam utilizadas quantidades equimolares de H2SO4 e NaOH, podemos concluir que:
A) a solução resultante será ácida, uma vez há excesso de H2SO4.
B) a solução resultante será básica, uma vez que há excesso de NaOH.
C) a solução resultante será neutra, uma vez que ambos os reagentes são consumidos completamente.
D) a solução resultante será neutra, uma vez que a formação do sal faz consumir qualquer quantidade restante de ácido ou base.
E) a solução resultante será básica, uma vez que a água formada aumenta a concentração de íons OH− em solução.
Alternativa A.
Se as quantidades são equimolares, então o número de mols para H2SO4 e NaOH é igual. Como não sabemos o valor, vamos dizer que o número de mols de ambas as substâncias é igual a n.
Ao se observar a reação química, percebe-se que:
1 mol de H2SO4 ---------------- 2 mols de NaOH
Proporcionalmente:
n mols de H2SO4 --------------- 2n mols de NaOH
Assim, a quantidade de n mols de H2SO4 necessita de 2n mols de NaOH para a reação de neutralização. Contudo, há apenas n mols de NaOH, o que significa que existe mais H2SO4 que o necessário, configurando que o ácido está em excesso. Portanto, a solução resultante será ácida.
-
Questão 9
A hidratação de alcenos pode levar à formação de álcoois mediante uma reação de adição. Um exemplo simples é a síntese do etanol a partir da hidratação do eteno.
C2H4 + H2O → C2H6O
Caso sejam utilizados 420 g de eteno e 360 g de água, é possível dizer que o reagente limitante e a massa de reagente em excesso são, respectivamente:
A) H2O, 140 g.
B) C2H4, 90 g.
C) C2H4, 60 g.
D) H2O, 90 g.
E) H2O, 60 g.
Alternativa B.
Com as massas indicadas, aferimos o número de mols (n) dos reagentes pela fórmula n = m/MM, em que m é a massa e MM é a massa molar.
Para o C2H4 → n = 420 g/28 g/mol; n = 15 mols.
Para o H2O → n = 360 g/18 g/mol; n = 20 mols.
Pela reação, percebe-se que se 1 mol de eteno precisa de 1 mol de água, proporcionalmente 15 mols de eteno necessitam de 15 mols de H2O. Contudo, vê-se que há 20 mols de H2O, ou seja, além do necessário para a reação completa. Por conta disso, a água é o reagente em excesso e o C2H4 é o reagente limitante.
Para se determinar a massa de água que está em excesso, devemos entender que, na reação entre eteno e água, 15 mols de eteno irão consumir 15 mols de água; logo, dos 20 mols de água, 5 mols irão sobrar.
A massa de 5 mols de água é determinada também pela fórmula n = m/MM.
n = m/MM
m = n ∙ MM
m = 5 mols ∙ 18 g/mol
m = 90 g de H2O em excesso
-
Questão 10
A hidrólise da ureia é uma reação que permite a produção da amônia, tendo o dióxido de carbono como subproduto.
CO(NH2)2 (s) + H2O (l) → 2 NH3 (g) + CO2 (g)
Se forem utilizados 1200 gramas de ureia e 540 gramas de água, o volume total de gases produzido, nas CNTP, é igual a:
A) 224 L.
B) 448 L.
C) 1344 L.
D) 2240 L.
E) 2688 L.
Alternativa B.
Com as massas indicadas, aferimos o número de mols (n) dos reagentes pela fórmula n = m/MM, em que m é a massa e MM é a massa molar.
Para o CO(NH2)2 → n = 1200 g/60 g/mol; n = 20 mols.
Para o H2O → n = 540 g/18 g/mol; n = 30 mols.
Pela reação, percebe-se que se 1 mol de ureia precisa de 1 mol de água, proporcionalmente 20 mols de ureia necessitam de 20 mols de H2O. Contudo, vê-se que há 30 mols de H2O, ou seja, além do necessário para a reação completa. Por conta disso, a água é o reagente em excesso e a ureia é o reagente limitante.
Com a quantidade do reagente limitante, determinamos a quantidade de gases produzida:
1 mol CO(NH2)2 -------------- 3 mols de gás (2 mols de NH3 + 1 mol de CO2)
20 mols CO(NH2)2 ---------- x
Assim, pela regra de 3, x é igual a 60 mols.
O volume total de gases, nas CNTP, é determinado pela fórmula n = V/VM, em que V é o volume de gás e VM é o volume molar que, nas CNTP, é de 22,4 L/mol:
n = V/VM
V = n ∙ VM
V = 20 mol ∙ 22,4 g/mol
V = 448 L de gás
-
Questão 11
A análise de uma amostra de 2,0 g de carbonato de cálcio, CaCO3, foi realizada com uma solução de ácido clorídrico, a qual contém 0,02 mol do ácido. Durante a análise, ocorreu a seguinte reação química:
CaCO3 (s) + 2 HCl (aq) → CaCl2 (aq) + H2O (l) + CO2 (g)
Com base nas condições do problema, é possível verificar que:
A) todo carbonato de cálcio foi consumido, resultando na formação de 0,88 g de CO2.
B) a quantidade de ácido utilizada só é capaz de consumir 1,0 g do carbonato de cálcio.
C) a quantidade de ácido utilizada é capaz de dissolver até 4,0 g de carbonato de cálcio, estando então em excesso.
D) para a dissolução de 2,0 g de carbonato de cálcio, são necessários, pelo menos, 0,06 mol de ácido clorídrico.
E) após a secagem e filtração do sistema, percebeu-se uma massa residual de 2,22 g de cloreto de cálcio.
Alternativa B.
Com a massa indicada, aferimos o número de mols (n) do CaCO3 pela fórmula n = m/MM, em que m é a massa e MM é a massa molar.
n = 2 g/100 g/mol; n = 0,02 mol.
Pela reação, percebe-se que, se 1 mol de CaCO3 precisa de 2 mols de HCl, proporcionalmente 0,02 mol de CaCO3 necessita de 0,04 mol de HCl. Contudo, vê-se que há apenas 0,02 mol de HCl, ou seja, menos que o necessário para a reação completa. Por conta disso, o HCl é o reagente limitante e é completamente consumido ao longo do processo. Quando o HCl é totalmente consumido, a quantidade, em mols, de CaCO3 consumida é:
1 mol de CaCO3 ------------ 2 mols de HCl
x ------------------------------ 0,02 mol de HCl
O valor de x é igual a 0,01 mol de CaCO3.
A massa de CaCO3 consumida nessas condições é determinada pela fórmula n = m/MM:
n = m/MM
m = n ∙ MM
m = 0,01 ∙ 100 g/mol
m = 1,0 g de CaCO3
-
Questão 12
A hidrazina, N2H4, pode ser utilizada como propelente para satélites artificiais. Uma forma de obtenção dela ocorre segundo a reação:
N2O (g) + 6 NH3 (g) → 4 N2H4 (l) + H2O (l)
O volume máximo aproximado de hidrazina produzido, nas CNTP, quando 11,2 L de N2O reagem com 22,4 L de NH3, ambos na CNTP, também é:
A) 89,6 L.
B) 22,4 L.
C) 30 L.
D) 7,5 L.
E) 15 L.
Alternativa E.
Com os volumes indicados, aferimos o número de mols (n) dos reagentes pela fórmula n = V/VM, em que V é o volume da substância e VM é o volume molar, que, nas CNTP, é igual a 22,4 L/mol.
Para o N2O → n = 11,2 L/22,4 L/mol; n = 0,5 mol.
Para o NH3 → n = 22,4 L/22,4 L/mol; n = 1 mol.
Pela reação, percebe-se que 1 mol de N2O precisa de 6 mols de NH3. Proporcionalmente, 0,5 mol de N2O necessita de 3 mols de NH3. Contudo, vê-se que há apenas 1 mol de NH3, ou seja, menos que o necessário para a reação completa. Por conta disso, o NH3 é o reagente limitante e será totalmente consumido ao longo do processo.
Com a quantidade do reagente limitante, determinamos a quantidade de N2H4 produzida:
6 mols de NH3 -------------- 4 mol N2H4
1 mol de NH3 ---------- x
Assim, pela regra de 3, x é igual a, aproximadamente, 0,67 mol de N2H4.
O volume total de N2H4, nas CNTP, é determinado pela fórmula n = V/VM, em que V é o volume de gás e VM é o volume molar, que, nas CNTP, é de 22,4 L/mol:
n = V/VM
V = n∙VM
V = 0,67 ∙ 22,4 g/mol
V = 15 L de gás
