Exercícios sobre a temperatura de ebulição dos compostos orgânicos
Estes exercícios testarão seus conhecimentos sobre a temperatura de ebulição dos compostos orgânicos, propriedade que é influenciada por dois fatores.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
(PUC-MG) Observe atentamente os hidrocarbonetos abaixo:
I. (CH3)4C
II. CH3(CH2)3CH3
III. CH3(CH2)2CH3
IV. CH3CH2CH(CH3)2
A ordem crescente do ponto de ebulição dos hidrocarbonetos dados é:
a) III, I, IV, II
b) I, III, II, IV
c) II, III, I, IV
d) III, I, II, IV
e) IV, II, I, III
Letra a). Todos os compostos presentes nas alternativas são alcanos, cuja fórmula geral é CnH2n+2, logo, apresentam a mesma força intermolecular, que é o dipolo induzido, já que todos eles são apolares.
Assim, para determinar a ordem de ponto de ebulição, devemos calcular a massa molar e analisar a cadeia que apresenta mais ramificações, já que, quanto menor a massa molar, menor o ponto de ebulição e, quanto menor a quantidade de ramificações, maior o ponto de ebulição.
-
I - possui fórmula C5H12, massa molar igual a 72 g/mol e 4 ramificações;
-
II - possui fórmula C5H12, massa molar igual a 72 g/mol e nenhuma ramificação (é uma cadeia linear);
-
III - possui fórmula C4H10, massa molar igual a 58 g/mol e 4 ramificações;
-
IV- possui fórmula C5H12, massa molar igual a 72 g/mol e 1 ramificação.
Assim, temos que:
III < I < IV < II
-
-
Questão 2
(ITA-SP) Assinale a opção CORRETA em relação à comparação das temperaturas de ebulição dos seguintes pares de substâncias:
a) Éter dimetílico > etanol; propanona > ácido etanoico; naftaleno < benzeno;
b) Éter dimetílico < etanol; propanona < ácido etanoico; naftaleno > benzeno;
c) Éter dimetílico > etanol; propanona < ácido etanoico; naftaleno > benzeno;
d) Éter dimetílico > etanol; propanona > ácido etanoico; naftaleno > benzeno;
e) Éter dimetílico < etanol; propanona < ácido etanoico; naftaleno < benzeno.
Letra b). Veja as fórmulas estruturais desses compostos:
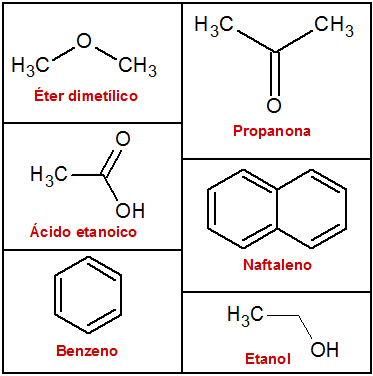
Quando comparamos compostos de funções químicas diferentes, o ponto de ebulição é maior quanto maior é a força intermolecular (ligação de hidrogênio > dipolo-dipolo > dipolo induzido). Já em compostos de mesma função química ou de mesmo tipo de força intermolecular, quanto maior for a massa molar do composto, maior será o ponto de ebulição.
Com relação aos compostos fornecidos, temos que:
-
Etanol → fórmula C2H6O, massa molar igual a 46 g/mol, é um álcool e apresenta força do tipo ligações de hidrogênio;
-
Éter dimetílico → fórmula C2H6O, massa molar igual a 46 g/mol, é um éter e apresenta força do tipo dipolo-dipolo;
-
Propanona → fórmula C3H6O, massa molar igual a 58 g/mol, é uma cetona e apresenta força do tipo dipolo-dipolo;
-
Ácido etanoico → fórmula C2H4O2, massa molar igual a 60 g/mol, é um ácido carboxílico e apresenta força do tipo ligações de hidrogênio;
-
Naftaleno → fórmula C10H8, massa molar igual a 128 g/mol, é um hidrocarboneto aromático e apresenta força do tipo dipolo-induzido;
-
Benzeno → fórmula C6H6, massa molar igual a 78 g/mol, é um hidrocarboneto aromático e apresenta força do tipo dipolo-induzido.
-
-
Questão 3
Analise os compostos a seguir e indique aquele que apresenta o maior ponto de ebulição.
a) H3C – CHO
b) HCOO – CH3
c) H3C – COOH
d) H3C – O – CH3
e) H3C – CH2 – OH
Letra c). Todos os compostos presentes nas alternativas pertencem a funções químicas diferentes, logo, para avaliar qual deles apresenta maior ponto de ebulição, devemos avaliar qual deles apresenta a maior massa e o tipo de força mais intenso.
-
Etanal → fórmula C2H4O, massa molar igual a 44 g/mol, é um álcool e apresenta força do tipo dipolo-dipolo;
-
Éter dimetílico → fórmula C2H6O, massa molar igual a 46 g/mol, é um éter e apresenta força do tipo dipolo-dipolo;
-
Metanoato de metila → fórmula C2H4O2, massa molar igual a 60 g/mol, é um ácido carboxílico e apresenta força do tipo dipolo-dipolo;
-
Ácido etanoico → fórmula C2H4O2, massa molar igual a 60 g/mol, é um ácido carboxílico e apresenta força do tipo ligações de hidrogênio;
-
Etanol → fórmula C2H6O, massa molar igual a 46 g/mol, é um álcool e apresenta força do tipo ligações de hidrogênio.
-
-
Questão 4
Analise os compostos a seguir e indique aquele que apresenta o menor ponto de ebulição.
a) metano.
b) metanol.
c) etano.
d) etanol.
e) metoximetano.
Letra a). Dos compostos fornecidos, temos dois álcoois (metanol e etanol), dois hidrocarbonetos alcanos (metano e etano) e um éter. Como o exercício deseja a identificação do composto orgânico de menor ponto de ebulição, trata-se daquele de menor massa e força intermolecular menos intensa.
Como temos hidrocarbonetos no exercício e eles possuem dipolo induzido, logo, um deles apresenta o menor ponto de ebulição, sendo especificamente o metano, que apresenta a menor massa.
