Exercícios sobre teorias ácido-base
Esta lista de exercícios sobre teorias ácido-base apresenta questões que abordam as teorias de Arhenius, Bronsted-Lowry e Lewis.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Dadas as espécies químicas a seguir, qual delas pode ser classificada como um ácido de Arrhenius?
a) Na2CO3
b) KOH
c) Na2O
d) HCl
e) LiH
Letra d). O HCl é a única espécie que apresenta na sua constituição o hidrogênio ligado a uma ametal ou a um grupo aniônico.
-
Questão 2
(FGV SP) A amônia é um composto muito versátil, pois seu comportamento químico possibilita seu emprego em várias reações químicas em diversos mecanismos reacionais, como em
I- HBr(g) + NH3(aq) → NH4+(aq) + Br–(aq)
II- NH3(g) + CH3–(g) → CH4(g) + NH2–(g)De acordo com o conceito ácido-base de Lewis, em I a amônia é classificada como _______. De acordo com o conceito ácido-base de Brösnted-Lowry, a amônia é classificada em I e II, respectivamente, como _______ e _______.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas.
a) base … ácido … base
b) base … base … ácido
c) base … ácido… ácido
d) ácido … ácido … base
e) ácido … base … base
Letra b). A amônia é considerada uma base de Lewis por apresentar elétrons livres, pois o N é da família VA (tem cinco elétrons) e utiliza três elétrons nas ligações com os hidrogênios, sobrando assim dois elétrons.
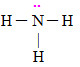
Fórmula estrutural da amôniaJá segundo a teoria de Bronsted-Lowry, na equação I, a amônia é uma base porque recebe um H para tornar-se um NH4+; mas, na equação II, ela é um ácido porque doa um H+ e transforma-se em NH2–.
-
Questão 3
(FGV SP) A água participa em reações com diversas espécies químicas, o que faz com que ela seja empregada como solvente e reagente; além disso, ela toma parte em muitos processos, formando espécies intermediárias e mais reativas.
I. HNO2 + H2O → NO2– + H3O+
II. NH3 + H2O → NH4+ + OH–
III. O2– + H2O → OH– + OH–De acordo com a teoria de ácidos e bases de Brönsted-Lowry, a classificação correta da água nas equações I, II e III é, respectivamente:
a) base, base e ácido.
b) base, ácido e ácido.
c) base, ácido e base.
d) ácido, base e ácido.
e) ácido, base e base.
Letra b). A água é base em I porque recebe um H e transforma-se em H3O+ e ácido em II e III porque doa um H e transforma-se em OH-.
-
Questão 4
(UNIUBE MG) Uma maneira de extração do petróleo atualmente é através do pré-sal, mesmo sendo um método que produz grande poluição devido aos seus muitos derivados, como, por exemplo, o enxofre, o dióxido de carbono e outros gases poluentes. Acredita-se que esses fatores devem ser considerados na decisão de exploração desse tipo de petróleo, pois os benefícios podem significar a contramão do processo de evolução do homem. Outro fator importante é que os oceanos, além das plantas, atuam na retirada do excesso de dióxido de carbono da atmosfera em aproximadamente 30% do que é emitido no mundo anualmente, e podendo interferir na formação de corais, conchas, podendo comprometer a cadeia alimentar dos animais marinhos. O gás carbônico, quando reage com a água, pode formar os seguintes equilíbrios químicos:
CO2(g) + H2O(l) → H2CO3(aq)
H2CO3(aq) + H2O(l) → H3O+(aq) + HCO3–(aq)
HCO3–(aq) + H2O(l) → H3O+(aq) + CO32–(aq)Observando essas reações, é possível afirmar que:
I. A água é considerada um ácido de Arrhenius ao interagir com o dióxido de carbono.
II. O H2CO3 é um ácido de Bronsted e Lowry.
III. O íon H3O+ é um ácido conjugado, segundo Bronsted e Lowry.
IV. As espécies na equação química H2CO3 e HCO3- são consideradas, respectivamente, ácido e base conjugada, segundo Bronsted e Lowry.
V. As espécies HCO3– e CO32– podem ser consideradas, respectivamente, ácido e base conjugada, segundo Bronsted e Lowry.
Estão CORRETAS as afirmativas contidas em:
a) I, II e IV, apenas
b) II, III, e V, apenas
c) I, II, V, apenas
d) I, III, IV e V, apenas
e) II, III, IV e V, apenas
Letra e).
O item I está errado porque a espécie só pode considerada um ácido de Arrhenius se produzir um hidrônio (H3O+). Na equação, a H2O forma H2CO3.
-
Questão 5
Tendo conhecimento sobre a teoria ácido-base de Lewis e considerando as possíveis reações que podem ocorrer entre as espécies, indique quantas das espécies a seguir agem como um ácido ou uma base:
H3O+, H2O, OH– e H+
a) Três ácidos e duas bases.
b) Dois ácidos e uma base.
c) Um ácido e uma base.
d) Dois ácidos e duas bases.
e) Um ácido e duas bases.
Letra e).
As bases de Lewis são materiais capazes de doar um par de elétrons. Por conta disso, as espécies H2O e OH- são bases. O H2O é uma base porque o oxigênio, que é da família VIA, tem seis elétrons e utiliza só dois desses elétrons com os hidrogênios, sobrando quatro (dois pares de elétrons). A diferença entre o OH- para o H2O é a ausência de um hidrogênio. Por isso, esse grupo tem seis elétrons livres.
O H+ é um ácido de Lewis porque é capaz de receber um par de elétrons (o + indica que o H não possui nenhum elétron e, como o seu número atômico é igual a 1, pode receber um par de elétrons).
O H3O+ não é nem ácido (não necessita receber um par de elétrons) nem base (doador de par de elétrons).