Exercícios sobre fórmula estrutural
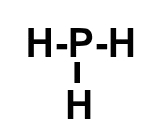
A fosfina é uma substância gasosa de alta inflamabilidade, proveniente da decomposição de cadáveres (material orgânico). Como esse gás queima-se à temperatura ambiente, se estiver presente na superfície dos túmulos e o clima for relativamente quente, pode ocorrer uma explosão espontânea. Sabendo que a sua fórmula molecular é PH3, podemos afirmar que nela encontramos:
a) 2 ligações duplas.
b) 3 ligações simples.
c) 2 ligações simples e uma ligação dupla.
d) 2 ligações duplas e uma ligação simples.
e) 2 ligações simples e uma ligação dativa.
Letra b). Para saber quais são as ligações presentes na fosfina (PH3), é necessário, antes, conhecer a necessidade de cada um dos átomos presentes nessa substância:
-
P = 3 ligações, pois, por pertencer à família VA, faltam-lhe três elétrons para completar oito na camada de valência, segundo a Teoria do Octeto;
-
H = 1 ligação, pois esse elemento possui um elétron na camada de valência e, por apresentar o número atômico 1, falta-lhe apenas mais um elétron para atingir a estabilidade, assim como o elemento hélio.
A montagem dessa estrutura ocorre conforme a seguinte sequência:
1o: posicionar o fósforo como átomo central por ele realizar mais ligações;
2o: posicionar os três átomos de hidrogênio em torno do fósforo (leste, oeste, sul);
3o: colocar uma ligação simples entre cada um dos hidrogênios e o fósforo, já que cada átomo de hidrogênio necessita de uma ligação.
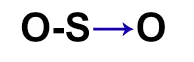
O dióxido de enxofre (SO2) é um gás incolor, produzido, por exemplo, na queima de combustíveis fósseis em veículos automotores ou em por processos industriais. Qual das fórmulas estruturais seguintes pertence a esse gás?
a)
b)
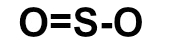
c)
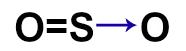
d)
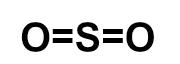
e)
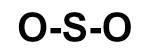
Letra c). Para montar a estrutura do SO2, é necessário, antes, conhecer a necessidade de cada um dos átomos presentes nessa substância:
-
S = 2 ligações, pois esse elemento pertence à família VIA, ou seja, faltam-lhe dois elétrons para completar oito na camada de valência, segundo a Teoria do Octeto;
-
O = 2 ligações, pois pertence à família VIA.
A montagem dessa estrutura obedece a seguinte sequência:
-
1o: posicionar o enxofre como átomo central, pois ele realiza mais ligações e é menos eletronegativo que o oxigênio, e pela dificuldade dos átomos de oxigênio em ligar entre si;
-
2o: posicionar os quatro átomos de oxigênio em torno do enxofre (leste e oeste);
-
3o: colocar uma ligação dupla entre um dos átomos de oxigênio e o enxofre, já que sempre se deve preocupar com as ligações dos átomos nas extremidades por causa da necessidade de duas ligações do oxigênio;

Obs.: Ao posicionar a ligação dupla, o átomo de enxofre também se torna estável, pois também necessita de duas ligações.
-
4o: como enxofre já está estável e o outro oxigênio ainda necessita de uma ligação, utilizamos uma ligação dativa entre ambos.
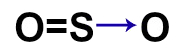
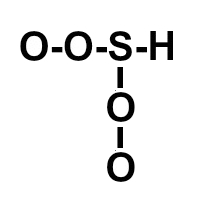
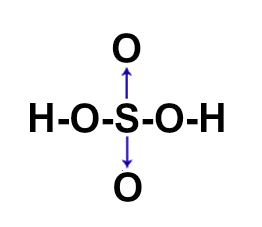
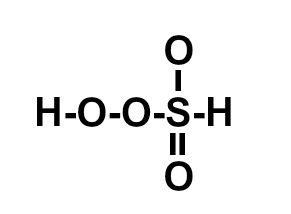
(ITA-SP) A posição relativa dos átomos na molécula do ácido sulfúrico é melhor representada por:
a)
b)
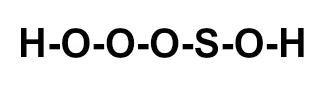
c)
d)
e)
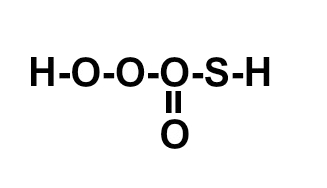
Letra c). O ácido sulfúrico apresenta fórmula molecular H2SO4. Assim, deve-se seguir a necessidade de ligações de cada elemento :
-
H = 1 ligação, pois esse elemento possui um elétron na camada de valência e, por ter número atômico 1, falta-lhe apenas mais um elétron para atingir a estabilidade, assim como o elemento hélio;
-
S = 2 ligações, pois, por pertencer à família VIA, faltam-lhe dois elétrons para completar oito na camada de valência, segundo a Teoria do Octeto;
-
O = 2 ligações, por pertencer à família VIA.
A montagem dessa estrutura obedece a seguinte sequência:
-
1o: posicionar o enxofre como átomo central, pois ele realiza mais ligações e é menos eletronegativo que o oxigênio, e pela dificuldade dos átomos de oxigênio em ligar entre si;
-
2o: posicionar os quatro átomos de oxigênio em torno do enxofre (norte, sul, leste oeste);
-
3o: posicionar os dois hidrogênios de forma que cada um esteja em um átomo de carbono.
(Unifor-CE) Em todas as moléculas representadas a seguir, os átomos diferentes unem-se entre si por apenas um par de elétrons. A que possui o maior número de ligações desse tipo é:
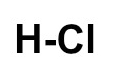
a) HCl
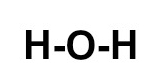
b) H2O
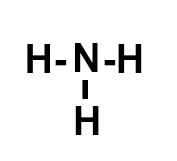
c) NH3
d) N2H4
e) CH4
Letra d). As ligações que apresentam um par de elétrons são a simples e a dativa. Porém, para saber qual das estruturas apresenta o maior número dessas ligações, devemos conhecer a necessidade de cada átomos da molécula e sua fórmula estrutural:
a) A molécula possui:
-
Cl = 1 ligação, pois, por pertencer à família VIIA, falta-lhe um elétron para completar oito na camada de valência, segundo a Teoria do Octeto;
-
H = 1 ligação, pois possui um elétron na camada de valência e, por ter número atômico 1, falta-lhe apenas mais um elétron para atingir a estabilidade, como ocorre com o elemento hélio.
Assim, a montagem dessa estrutura terá apenas o H ao lado do Cl, com uma ligação simples entre eles, já que ambos precisam de uma ligação.
b) A molécula possui:
-
H = 1 ligação, pois possui um elétron na camada de valência e, por ter número atômico 1, falta-lhe apenas mais 1 elétron para atingir a estabilidade, como ocorre com o elemento hélio;
-
O = 2 ligações, pois, por pertencer à família VIA, faltam-lhe dois elétrons para completar oito na camada de valência, segundo a Teoria do Octeto.
Assim, a montagem dessa estrutura obedece a seguinte sequência:
-
1o: posicionar o oxigênio como átomo central por ele realizar mais ligações;
-
2o: posicionar os dois átomos de hidrogênio em torno do oxigênio (leste e oeste);
-
3o: colocar uma ligação simples entre cada um dos hidrogênios e o oxigênio, já que cada átomo de hidrogênio necessita de uma ligação.
c) A molécula possui:
-
N = 3 ligações, pois, por pertencer à família VA, faltam-lhe três elétrons para completar oito na camada de valência, segundo a Teoria do Octeto;
-
H = 1 ligação, pois possui um elétron na camada de valência e, por ter número atômico 1, falta-lhe apenas mais um elétron para atingir a estabilidade, como ocorre com o elemento hélio.
Assim, a montagem dessa estrutura obedece a seguinte sequência:
1o: posicionar o nitrogênio como átomo central por ele realizar mais ligações;
2o: posicionar os três átomos de hidrogênio em torno do nitrogênio (leste, oeste, sul);
3o: colocar uma ligação simples entre cada um dos hidrogênios e o fósforo, já que cada átomo de hidrogênio necessita de uma ligação.
d) A molécula possui:
-
N = 3 ligações, pois, por pertencer à família VA, faltam-lhe três elétrons para completar 8 na camada de valência, segundo a Teoria do Octeto;
-
H = 1 ligação, pois possui um elétron na camada de valência e, por ter número atômico 1, falta-lhe apenas mais um elétron para atingir a estabilidade, como ocorre com o elemento hélio.
A montagem dessa estrutura obedece a seguinte sequência:
1o: os dois nitrogênios serão posicionados como átomos centrais, pois, por realizarem mais ligações, ocorre entre eles uma ligação simples;
2o: posicionar os dois átomos de hidrogênio em torno de cada átomo de nitrogênio;
3o: colocar uma ligação simples entre cada um dos hidrogênios, já que cada átomo desse elemento necessita de uma ligação.
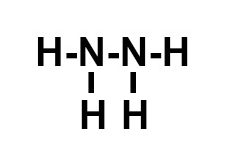
e) A molécula possui:
-
N = 3 ligações, pois, por pertencer à família VA, faltam-lhe três elétrons para completar 8 na camada de valência, segundo a Teoria do Octeto;
-
H = 1 ligação, pois possui um elétron na camada de valência e, por ter número atômico 1, falta-lhe apenas mais um elétron para atingir a estabilidade, como o elemento hélio.
A montagem dessa estrutura obedece a seguinte sequência:
1o: posicionar o carbono como átomo central por ele realizar mais ligações;
2o: posicionar os quatro átomos de hidrogênio em torno do carbono (leste, oeste, norte e sul);
3o: colocar uma ligação simples entre cada um dos hidrogênios e o carbono, já que cada átomo de hidrogênio necessita de uma ligação.