Exercícios sobre geometria molecular
(IMT) Considerando as geometrias moleculares a seguir, assinale a alternativa que representa corretamente as moléculas de amônia, clorometano e gás carbônico.
A) 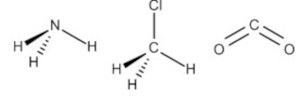
B) 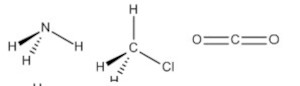
C) 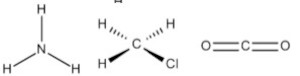
D) 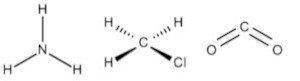
E) 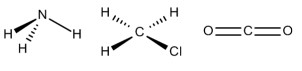
Alternativa B.
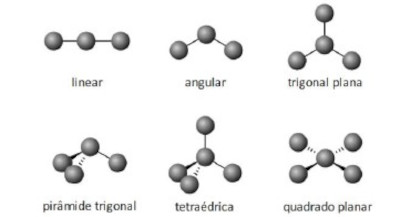
Para determinar a geometria molecular de uma molécula é necessário avaliar o arranjo dos átomos que a constituem.
Por exemplo, a molécula de amônia (NH3) possui um arranjo tetraédrico devido ao par de elétrons não compartilhado do nitrogênio. Porém, como o que importa é o formato que a molécula adquire com os átomos ligantes, então sua geometria é a pirâmide trigonal. O clorometano (ClCH3) tem o carbono com quatro ligantes, ou seja, uma molécula do tipo AB4 completa (com nenhum par de elétrons não ligantes no átomo central), logo sua geometria molecular é tetraédrica. Por fim, temos o gás carbônico (CO2), em que cada átomo de oxigênio forma uma dupla ligação com o carbono (O=C=O), ou seja, uma molécula do tipo AB2 completa, logo geometria linear.
Portanto, a única opção que se encaixa no gabarito é a alternativa B.
(Urca) Qual das substâncias abaixo tem molécula apolar linear e apresenta ligações duplas?
A) HCl
B) H2O
C) N2
D) CO2
E) NH3
Alternativa D.
A questão exige conhecimento sobre três conceitos: polaridade, geometria molecular e ligações químicas, os quais estão intimamente relacionados. Posto isso, para fins de eliminação vamos identificar as moléculas com ligações simples: HCl, H2O e NH3. Logo, nos resta apenas as opções C e D.
Tanto N2 quanto CO2 são moléculas lineares devido às ligações múltiplas existentes entre seus átomos, sendo uma tripla na molécula de N2 (N≡N) e duas duplas na molécula de CO2 (O=C=C). Nesse caso, a resposta é a alternativa D.
(UEA) Leia o texto para responder à questão.
O processo de conversão do nitrogênio atmosférico (N2) em moléculas que as plantas possam utilizar, como, por exemplo, a amônia (NH3), é feito por bactérias que produzem uma enzima chamada nitrogenase, que é __1__ a energia de ativação da conversão de N2 em NH3, tornando a reação mais rápida. A nitrogenase, assim como outras enzimas, são chamadas de __2__.
A geometria molecular e a polaridade da molécula de amônia são:
A) plana trigonal e polar.
B) tetraédrica e polar.
C) pirâmide trigonal e polar.
D) tetraédrica e apolar.
E) pirâmide trigonal e apolar.
Alternativa C.
A geometria molecular da amônia é oriunda de uma molécula do tipo AB4 (1 átomo central e 4 ligantes), que é tetraédrica. Contudo, quando não possuem um quarto ligantes, ficando apenas com 3, haverá um par de elétrons livre no átomo central (N) que irá gerar uma repulsão nos pares de elétrons ligantes, dando uma nova configuração à molécula, que passa a ser pirâmide trigonal. Além disso, esse par de elétrons livres gera uma diferença de eletronegatividade na molécula diferente de zero, ou seja, a molécula é polar.
(UEMG) Assinale a alternativa que apresenta corretamente a geometria molecular dos compostos tetrafluoreto de silício, pentacloreto de fósforo, hidreto de fósforo e íon nitrito, respectivamente.
A) Tetraédrica, piramidal quadrada, trigonal planar e forma de “T”.
B) Tetraédrica, bipirâmide trigonal, pirâmide trigonal e angular.
C) Pirâmide trigonal, bipiramidal trigonal, pirâmide trigonal e trigonal planar.
D) Tetraédrica, bipiramidal trigonal, trigonal planar e angular.
Alternativa B.
Primeiramente devemos identificar as fórmulas moleculares dos compostos citados: tetrafluoreto de silício (SiF4), pentacloreto de fósforo (PCl5), hidreto de fósforo (PH3) e íon nitrito (NO2-).
O SiF4 possui 4 domínios eletrônicos, nos quais todos são ligantes, isto é, uma molécula do tipo AB4 que assume geometria tetraédrica, logo se elimina a alternativa “c”. O PCl5 é do tipo AB5, em que o fósforo tem 5 domínios eletrônicos (5 pares de elétrons formando ligações), logo se trata de uma geometria bipiramidal (bipirâmide) trigonal. Quanto ao PH3, no átomo de P há um par de elétrons não ligante formando com as 3 ligações um total de 4 domínios eletrônicos, assim sendo o arranjo é tetraédrico; já a geometria será pirâmide trigonal. Por fim, o NO2- há um par de elétrons livres, formando um domínio não ligante, dando à molécula um arranjo AB3. Contudo, como só há dois domínios ligantes, sua geometria (para AB2) será do tipo angular.
O dióxido de enxofre (SO2) é um gás poluente liberado por processos industriais e um dos causadores da chuva ácida que apresenta qual geometria molecular?
A) linear
B) angular
C) trigonal plana
D) tetraédrica
E) bipiramidal trigonal
Alternativa D.
O enxofre no SO2 forma duas ligações duplas com oxigênios, formando uma molécula do tipo AB2, e possui um par de elétrons não ligantes, o que, segundo a teoria VSEPR, gera uma geometria resultante angular.
O formaldeído (H2CO), presente em alguns produtos de alisamento capilar, pode ser estudado com base na geometria molecular. Nesse contexto, sabendo que o átomo central é o carbono, qual é a geometria da molécula de formaldeído?
A) linear
B) angular
C) trigonal plana
D) tetraédrica
E) bipiramidal trigonal
Alternativa C.
O formaldeído possui um carbono central ligado a dois átomos de hidrogênio e um oxigênio por ligação dupla, sem pares de elétrons não ligantes, ou seja, é do tipo AB3, com três domínios ligantes. Isso confere à molécula uma geometria trigonal plana.
O ozônio (O3) é utilizado na purificação de água devido às suas propriedades oxidantes. Considerando que o ozônio é uma molécula angular, qual a justificativa para essa geometria?
A) Presença de ligações simples
B) Ligação dupla entre átomos de oxigênio
C) Carbono sp3 hibridizado
D) Ausência de pares de elétrons não ligantes
E) Presença de pares de elétrons não ligantes no oxigênio central
Alternativa E.
O ozônio (O3) tem um oxigênio central que faz ligações com dois outros átomos de oxigênio e possui um par de elétrons não ligantes, resultando em uma geometria angular.
O amoníaco (NH3) e o cloreto de boro (BCl3) são compostos presentes em diversos processos industriais e farmacêuticos. Com base na teoria da repulsão dos pares de elétrons, qual é a geometria molecular desses compostos?
A) NH3 é piramidal e BCl3 é trigonal plana
B) NH3 é trigonal plana e BCl3 é tetraédrico
C) NH3 é tetraédrico e BCl3 é linear
D) NH3 é linear e BCl3 é piramidal
E) NH3 é trigonal bipiramidal e BCl3 é angular
Alternativa A.
O amoníaco (NH3) possui geometria piramidal devido ao par de elétrons não ligantes no nitrogênio, pois, embora seu arranjo seja tetraédrico (AB4), sua geometria se estabelece no formato AB3. Já o cloreto de boro (BCl3) tem uma geometria trigonal plana, pois o boro está ligado a três átomos de cloro sem pares de elétrons não ligantes.
O trióxido de enxofre (SO3) o hexafluoreto de enxofre (SF6) são compostos utilizados na produção de materiais avançados. Quais são as geometrias moleculares dessas duas substâncias?
A) SO3 é trigonal plana, e SF6 é bipiramidal trigonal
B) SO3 é tetraédrica, e SF6 é bipiramidal trigonal
C) SO3 é trigonal plana, e SF6 é octaédrica
D) SO3 é piramidal, e SF6 é tetraédrica
E) SO3 é linear, e SF6 é octaédrica
Alternativa C.
O trióxido de enxofre (SO3) tem geometria trigonal plana, pois o enxofre está ligado a três oxigênios, gerando 3 domínios eletrônicos, sem pares de elétrons não ligantes. Já o hexafluoreto de enxofre (SF6) tem geometria octaédrica, pois o enxofre faz 6 ligações e, nesse caso, ele está ligado a seis átomos de F, distribuídos simetricamente, formando uma molécula AB6 tipicamente octaédrica.
Os gases tetrafluoreto de carbono (CF4) e triclorofluorometano (CCl3F), conhecidos como CFCs, foram amplamente utilizados em aerossóis, mas causaram danos à camada de ozônio. Considerando a teoria da repulsão dos pares eletrônicos, quais são as geometrias moleculares dessas duas moléculas, respectivamente?
A) tetraédrica e trigonal plana
B) tetraédrica e tetraédrica
C) trigonal plana e piramidal
D) trigonal plana e angular
E) bipiramidal trigonal e trigonal plana
Alternativa B.
Ambas as moléculas possuem geometria tetraédrica. No CF4, o carbono está ligado a quatro flúores (F). No CCl3F, o carbono está ligado a três cloros e um flúor. Em ambos os casos, a disposição dos átomos ao redor do carbono segue a geometria tetraédrica, já que o limite de domínios ligantes para o carbono é 4.
O fosgênio (COCl2) é utilizado no tratamento e na conservação de alimentos, embora em baixas concentrações. Com base no modelo VSEPR, determine qual a geometria molecular desse composto.
A) trigonal plana
B) piramidal
C) tetraédrica
D) linear
E) bipiramidal trigonal
Alternativa A.
O fosgênio (COCl2) tem um átomo de carbono central ligado a um oxigênio e dois átomos de cloro, formando uma molécula do tipo AB3 com três domínios eletrônicos ligantes. Portanto, a única possibilidade é uma geometria trigonal plana.
O hexafluoreto de urânio é um composto utilizado no processo de enriquecimento de urânio para geração de energia nuclear. Sabendo que esse composto possui átomos de flúor ao redor de um átomo central de urânio, qual é a geometria molecular?
A) Linear
B) Trigonal bipiramidal
C) Octaédrica
D) Tetraédrica
E) Trigonal plana
Alternativa C.
Primeiro, precisamos definir a fórmula molecular do hexafluoreto de urânio, que é UF6. Ou seja, ele possui 6 domínios eletrônicos ligantes que se distribuem simetricamente ao redor do urânio, sem pares de elétrons não ligantes, o que resulta em uma geometria octaédrica típica das moléculas do tipo AB6.






