Exercícios sobre pureza dos reagentes
(UFRGS-RS) O gás hilariante, N2O(g), pode ser obtido pela decomposição térmica do nitrato de amônio, NH4NO3(s), conforme mostra a reação a seguir:
NH4NO3(s) → N2O(g) + 2 H2O(ℓ)
Se de 4,0 g do NH4NO3(s) obtivemos 2,0 g de gás hilariante, podemos prever que a pureza do sal é de ordem:
a) 100% b) 90% c) 75% d) 50% e) 20%
Alternativa “b”.
Primeiro escrevemos a equação da reação química balanceada:
NH4NO3(s) → N2O(g) + 2 H2O(ℓ)
Veja que a proporção estequiométrica entre o NH4NO3(s) e o N2O(g) é de 1 : 1. Agora, por meio das massas molares, calculamos a quantidade de hidróxido que produzirá 2,0 g de gás hilariante:
1 mol ---------------- 1 mol
80 g de NH4NO3(s)---- 44 g de N2O(g)
x----------------------- 2,0 g de N2O(g)
x = 3,63 g de NH4NO3(s)
Por fim, calculamos o grau de pureza em termos de porcentagem de NH4NO3(s):
4,0 g de NH4NO3(s) ------ 100%
3,63 g de NH4NO3(s) ---- p%
p% ≈ 90%
(Cesgranrio-RJ) Uma indústria adquire hidróxido de sódio impuro como matéria-prima para o seu processo. Segundo as normas da empresa, devem ser recusadas as remessas com teor de NaOH inferior a 80%. Três amostras designadas por I, II e III, contendo cada uma 5 gramas do produto são analisadas com H2SO4, sendo as massas de ácido consumidas na neutralização indicadas na tabela abaixo:
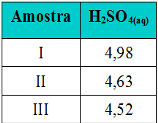
Tabela de exercício sobre amostras com impurezas
Do resultado da análise depreende-se que a(s) amostra(s) aprovada(s) foi (foram):
a) apenas a I.
b) apenas a II.
c) apenas a III.
d) apenas a I e a II.
e) apenas a II e a III.
Alternativa “a”.
Vamos ter que calcular o grau de pureza para as três amostras. A que tiver grau de pureza maior que 80% será aprovada.
Primeiro escrevemos a equação da reação química balanceada:
2 NaOH + 1 H2SO4→ Na2SO4 + 2 H2O(ℓ)
Veja que a proporção estequiométrica entre o 2 NaOH e o H2SO4 é de 2 : 1. Agora, por meio das massas molares, calculamos a quantidade de H2SO que reagirá com 5,0 g de NaOH:
2 mol . 40 g de NaOH ------- 1 . 98 g de H2SO4
5,0 g de NaOH ------------------- x
x = 5,0 . 98
2 . 40
x = 6,125 g de H2SO4
Por fim, calculamos o grau de pureza para cada amostra:
Amostra I: Amostra II:
6,125 g de H2SO4 ------ 100% 6,125 g de H2SO4 ------ 100%
4,98 g de H2SO4 ---- p% 4,63 g de H2SO4 ---- p%
p% ≈ 81,3% p% ≈ 75,6%
Amostra III:
6,125 g de H2SO4 ------ 100%
4,52 g de H2SO4 ---- p%
p% ≈ 73,8%
Apenas a amostra I está acima de 80% e, por isso, somente ela é aprovada.
Uma das formas de produção da amônia é a partir da reação entre a cal viva (óxido de cálcio) e o cloreto de amônio. Veja essa reação a seguir:
CaO(s) + 2 NH4Cl(s) → 2 NH3(g) + H2O(g) + CaCl2(s)
10,5 g de uma amostra de cal viva foram colocados para reagir com excesso de cloreto de amônio e foram produzidos 5,1 g de amônia. Qual é o grau de pureza em óxido de cálcio dessa amostra de cal viva usada?
a) 60%
b) 73%
c) 80%
d) 90%
e) 125%
Alternativa “c”.
Primeiro escrevemos a equação da reação química balanceada:
CaO(s) + 2 NH4Cl(s) → 2 NH3(g) + H2O(g) + CaCl2(s)
Veja que a proporção estequiométrica entre o CaO e a amônia (NH3) é de 1 : 2. Visto que o cloreto de amônio está em excesso, o óxido de cálcio é o reagente limitante e é somente ele que vamos considerar. Agora, por meio das massas molares, calculamos a quantidade de CaO que produzirá 5,1 g de amônia:
1 . 56 g de CaO---- 2 . 17 g de NH3
x----------------------- 5,1 g de NH3
x = 8,4 g de CaO
Por fim, calculamos o grau de pureza em termos de porcentagem de CaO:
10,5 g------ 100%
8,4 g ---- x
x = 80%
O dióxido de titânio é um pó branco, sendo o pigmento mais utilizado no mundo em tintas para superfícies metálicas e em plásticos. Ele apresenta muitas vantagens, como alta durabilidade e resistência ao calor. Esse composto passa por análises de pureza, e uma delas consiste em reagir uma amostra sua com trifluoreto de bromo com a formação de oxigênio como um dos produtos, como mostra a reação logo mais abaixo. A massa de oxigênio produzida é determinada e, com isso, pode-se verificar a pureza do dióxido de titânio.
3 TiO2(s) + 4 BrF3(l) → 3 TiF4(s) + 2 Br2(l) + 3 O2(g)
50 g de uma amostra de dióxido de titânio foram analisados dessa forma, tendo sido produzidos 14 g de gás oxigênio. Qual é a porcentagem, em massa, de dióxido de titânio nessa amostra?
(Dadas as massas molares em g/mol: Ti = 47,88; O = 16; Br = 79,9; F = 19).
a) 60%
b) 70%
c) 80%
d) 90%
e) 100%
Alternativa “b”.
Primeiro escrevemos a equação da reação química balanceada:
3 TiO2(s) + 4 BrF3(l) → 3 TiF4(s) + 2 Br2(l) + 3 O2(g)
Veja que a proporção estequiométrica entre o TiO2 e o O2 é de 3 : 3 ou de 1 : 1. Agora, por meio das massas molares, calculamos a quantidade de O2 que deve ser produzida com 14 g de gás oxigênio:
79,88 g de TiO2(s) ---- 32 g de O2(g)
x----------------------- 14 g de O2(g)
x ≈ 35 g de TiO2
Por fim, calculamos o grau de pureza em termos de porcentagem de TiO2:
50 g------ 100%
35 g ---- x
x = 70%






