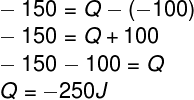Exercícios sobre a Primeira Lei da Termodinâmica para processos isobáricos
Esta é uma lista de exercícios sobre a Primeira Lei da Termodinâmica para os processos isobáricos, isto é, quando a pressão é mantida constante.
Publicado por: Rafael HelerbrockQuestões
-
Questão 1
Sobre os gases monoatômicos e ideais que passam por um processo de transformação isobárica, podemos afirmar corretamente que:
a) Toda a quantidade de calor (Q) cedida ao sistema será transformada em trabalho mecânico.
b) A quantidade de calor (Q) cedida ao sistema é diretamente proporcional à sua variação de temperatura.
c) A energia interna do gás (U) permanece constante.
d) A variação de energia interna(ΔU) é inversamente proporcional à variação volumétrica (ΔV).
e) A temperatura do gás varia, mas não há trocas de calor entre o sistema e o meio externo.
Letra B
De acordo com a 1ª Lei da Termodinâmica:
A variação da energia interna de um gás é dada pela diferença entre a quantidade de calor trocada com o meio externo e o trabalho realizado por ou sobre o gás.
Além disso, para os gases monoatômicos e ideais, a quantidade de calor cedida pode ser calculada pela equação a seguir:
Dessa forma, é fácil perceber que uma quantidade de calor Q é diretamente proporcional a uma variação de volume (ΔV). Essa equação pode ser reescrita em termos da mudança de temperatura (ΔT):
-
Questão 2
Um gás é submetido a um processo sob pressão constante de 400 N/m2 e sofre uma redução de seu volume em 0,25 m3. Assinale aquilo que for FALSO:
a) a quantidade de trabalho realizada sobre o gás foi de - 100 J;
b) a variação da energia interna é de -150 J;
c) o gás recebe 250 J de calor;
d) o gás cede 250 J de calor;
e) a variação de temperatura desse gás é negativa;
Letra C
a) Verdadeiro – Basta calcularmos o trabalho com a expressão:
De forma que:
b) Verdadeiro – Para calcular a variação da energia interna, utilizamos a relação:
Dessa forma, temos que:
c) Falso – Para calcular a quantidade de calor envolvida no processo, basta utilizar a 1ª Lei da Termodinâmica:
Sendo assim, temos que:
Como calculamos a quantidade de calor como uma quantidade negativa, podemos dizer que o gás está cedendo calor para o meio externo.
d) Verdadeiro – A quantidade de calor cedida pelo gás é de -250 J.
e) Verdadeiro – A quantidade de calor e a variação de temperatura são grandezas diretamente proporcionais, ou seja, uma quantidade de calor positiva causa uma variação de temperatura positiva e vice-versa.
-
Questão 3
Em uma transformação isobárica, a pressão do gás é _______, e sua energia interna aumenta se a diferença entre ______ e _______ for _________.
a) constante, calor, trabalho, nula.
b) constante, calor, trabalho, negativa.
c) variável, calor, trabalho, positiva.
d) constante, trabalho, calor, negativa.
e) constante, calor, trabalho, positiva.
-
Questão 4
Pode ser considerado um exemplo de processo isobárico:
a) Um balão de gás Hélio que sobe pelo empuxo atmosférico.
b) Aquecimento da água em um bule.
c) Água subindo pelo canudo devido à sucção.
d) Convecção do vapor de água.
Letra B
a) Falso - Como o balão sobe para níveis muito além do nível do mar, a pressão externa (atmosférica) diminui, portanto, não pode ser considerado um processo isobárico.
b) Verdadeiro - O aquecimento do líquido em um bule acontece sob pressão externa constante, portanto, pode ser considerado um processo isobárico.
c) Falso - A água sobe pelo canudo pela pressão hidrostática exercida.
d) Falso - Na convecção, as porções mais quentes dos fluidos tendem a fazer um movimento ascendente, logo, com a variação de altura, a pressão também muda, tratando-se, portanto, de um processo com pressão variável.