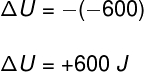Exercícios sobre transformação adiabática
Esta lista de exercícios testará seus conhecimentos sobre o processo termodinâmico da transformação adiabática, uma classe de transformações nas quais não há trocas de calor.
Publicado por: Rafael HelerbrockQuestões
-
Questão 1
Em relação às transformações adiabáticas, assinale o que for correto:
a) nas compressões adiabáticas, a temperatura e a pressão dos gases diminuem.
b) nas expansões adiabáticas, a temperatura e a pressão dos gases aumentam.
c) nas transformações adiabáticas, a troca de calor entre o gás e o meio externo é nula.
d) nas transformações adiabáticas, a temperatura do gás permanece constante.
e) em uma expansão adiabática, a energia interna dos gases tende a aumentar.
Letra C
Vamos analisar as alternativas:
a) Falso – Nas compressões adiabáticas, a pressão e a temperatura dos gases tendem a aumentar.
b) Falso – Nas expansões adiabáticas, a pressão e a temperatura dos gases tendem a diminuir.
c) Verdadeiro – Toda transformação adiabática ocorre sem que haja trocas de calor entre o gás e o meio externo.
d) Falso – Nas transformações adiabáticas, a temperatura do gás é variável. Nas compressões adiabáticas, a temperatura dos gases tende a aumentar; nas expansões desse tipo, a temperatura tende a diminuir.
e) Falso – Com a sua expansão, o gás perde energia para o meio externo e, portanto, sua energia interna diminui.
-
Questão 2
Um gás monoatômico e ideal sofre uma expansão adiabática, realizando sobre um pistão um trabalho termodinâmico igual a 400 J. Qual é a variação da energia interna do gás, em Joules?
a) -400 J
b) 400 J
c) 200 J
d) -200 J
e) -100 J
Letra A
De acordo com a 1ª Lei da Termodinâmica, sabemos que:
Para transformações adiabáticas, a quantidade de calor Q é igual a 0, dessa forma:
Como o gás sofreu uma expansão, ele realizou um trabalho positivo, ou seja, cedeu energia para o meio externo, logo, podemos dizer que sua variação de energia interna foi de:
-
Questão 3
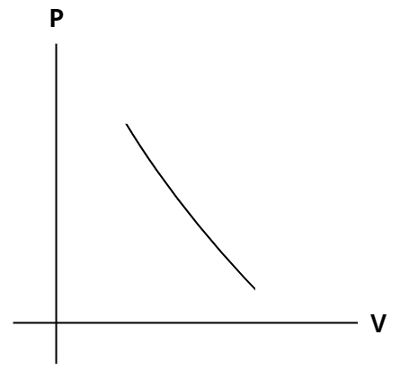
O gráfico genérico de uma transformação adiabática é mostrado a seguir:
De acordo com os seus conhecimentos sobre as transformações gasosas e por meio da análise do gráfico, podemos dizer que:
a) pressão e temperatura são grandezas inversamente proporcionais.
b) a quantidade de calor transferida é tão maior quanto maior for a inclinação da curva adiabática.
c) nas transformações adiabáticas, uma diminuição no volume do gás reduz sua pressão consideravelmente.
d) pressão e volume são grandezas diretamente proporcionais.
e) nas transformações adiabáticas, um aumento no volume do gás reduz sua pressão consideravelmente.
Letra E
Vamos analisar as alternativas:
a) Falso – De acordo com a Lei Geral dos gases, pressão e temperatura são grandezas diretamente proporcionais.
b) Falso – Nas transformações adiabáticas, não há trocas de calor.
c) Falso – O que se observa no gráfico é justamente o oposto: a diminuição de volume do gás leva a um aumento de pressão.
d) Falso – De acordo com o gráfico e pela Lei Geral dos Gases, pressão e volume guardam entre si uma relação de proporção inversa, ou seja, quando uma aumenta, a outra diminui;
e) Verdadeiro – A partir do gráfico, pode-se perceber uma grande variação de pressão em relação à variação volumétrica.
-
Questão 4
Um pistão comprime um gás, realizando um trabalho de 600 J sobre ele. Considerando que o pistão não permite a troca de calor entre o gás e o meio externo e que a transformação ocorreu muito rapidamente, indique a variação da energia interna sofrida pelo gás:
a) -600 J;
b) 300 J;
c) -200 J;
d) 1,50 V;
e) -300 J.
Letra C
De acordo com a 1ª Lei da Termodinâmica:
De acordo com a situação descrita no enunciado do exercício, a quantidade de calor Q é nula, pois o recipiente é adiabático e a transformação ocorre muito rapidamente. Logo, temos que:
Tomando os dados fornecidos pelo exercício:
Observe que o trabalho é realizado sobre o gás, portanto, é negativo. Dessa forma, ele é afetado pelo sinal da fórmula, passando a ficar positivo.
Veja também: Jogo de sinais
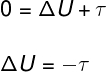
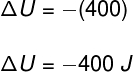
.jpg)
.jpg)