Enem: lista de exercícios sobre pilhas
Nesta lista de exercícios, você poderá testar o que aprendeu sobre pilhas, sistemas eletroquímicos que frequentemente aparecem na prova de Química do Enem.
Publicado por: Murilo XovenQuestões
-
Questão 1
(Unifor) A série eletroquímica, também designada por série eletromotriz, consiste numa série de elementos químicos dispostos por ordem dos seus potenciais de eletrodo. O eletrodo de hidrogênio é tomado como tendo potencial de eletrodo zero. Os elementos que possuem maior tendência que o hidrogênio para perder elétrons para as suas soluções são considerados eletropositivos. Aqueles que ganham das suas soluções estão abaixo do hidrogênio na série e são designados eletronegativos.
A série indica a ordem segundo a qual um metal desloca um outro nos seus sais. Os metais eletropositivos deslocam o hidrogênio dos ácidos. Os principais metais e o hidrogênio colocados por ordem crescente na série são: potássio, cálcio, sódio, magnésio, alumínio, zinco, cádmio, ferro, níquel, estanho, chumbo, hidrogênio, cobre, mercúrio, prata, platina, ouro. Assim sendo, assinale a alternativa que pode ser considerada correta.
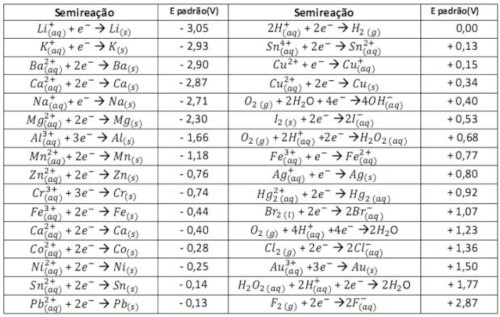
a) Uma ponte metálica de ferro com sapatas mergulhadas em um corpo d´água salino rico em íons de lítio, cálcio e cromo sofre oxidação e corrosão.
b) Uma janela com esquadrias de alumínio em contato com o ar sofre inicialmente processo de oxidação por ação do oxigênio (eletronegativo) e posterior processo de corrosão.
c) Uma placa metálica de cobre mergulhada em uma solução de iodeto de zinco sofrerá corrosão e tornará a solução azulada.
d) Uma placa de zinco mergulhada em solução cobre depositará sobre a placa de zinco uma camada de cobre avermelhado sólido.
e) O maior potencial de oxidação na série apresentada na figura pertence a um sistema contendo uma solução de mercúrio divalente positivo.
Letra D. Isso ocorrerá pois o potencial de redução do cobre (+0,34 V) é maior do que o do zinco (-0,76 V), portanto o cobre reduzirá e o zinco oxidará. O metal que sofre redução tende a ser eletrodepositado no eletrodo, o que justifica a camada avermelhada de cobre sólido.
-
Questão 2
(FGV) Uma cozinheira preparou um molho de tomate para ser consumido posteriormente, armazenando-o no refrigerador, em um recipiente de aço inoxidável coberto com uma folha de alumínio, conforme mostram as imagens.


Passados alguns dias, surgiram pequenos furos na folha de alumínio, como resultado da corrosão, que ocorreu devido ao fato de o molho de tomate ser uma solução eletrolítica e de dois metais diferentes terem sido colocados em contato, formando, assim, uma pilha.
Os potenciais-padrão de redução (E0) referentes aos componentes da pilha formada são:
Al 3+ (aq) + 3e– → Al (s) –1,66 V
2H2O (l) + ½ O2 (g) + 2e– → 2OH– (aq) + 0,40 V
Nessa pilha, o recipiente de aço inoxidável atuou como eletrodo inerte (condutor elétrico que não reage) com polaridade __________, e o alumínio, por sua vez, atuou como __________. O potencial-padrão dessa pilha é __________.
Assinale a alternativa que preenche as lacunas do texto.
a) negativa – ânodo – +2,06 V
b) negativa – cátodo – +4,52 V
c) positiva – ânodo – +2,06 V
d) positiva – ânodo – +4,52 V
e) positiva – cátodo – +2,06 V
Letra C. Como o potencial de redução do alumínio é menor, ele sofrerá oxidação. Sendo assim, ele é classificado como ânodo. Com isso, o aço inoxidável, mesmo sendo inerte, atua com polaridade positiva, visto que seu oposto, o ânodo, configura o polo positivo.
A ddp dessa pilha é de +2,06 V
DDP = Eº maior – Eº menor
DDP = +0,40 V – (-1,66 V)
DDP = +0,40 V + 1,66 V
DDP = +2,06 V
-
Questão 3
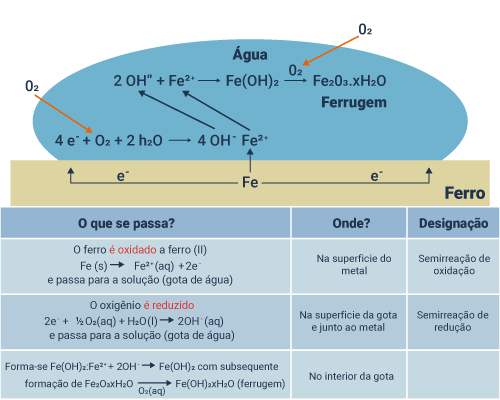
(UECE) Quando se fala em corrosão, é comum vir à mente a corrosão de metais, principalmente a do ferro, que gera a ferrugem. Porém, outros materiais podem sofrer corrosão, tais como os polímeros e as estruturas feitas de concreto armado. Tal processo representa para a sociedade uma grande perda econômica, pois todo tipo de corrosão está relacionado à diminuição do tempo de vida de um material. No que diz respeito a esse assunto, assinale a afirmação verdadeira.
a) A ferrugem é um exemplo de corrosão eletroquímica. Nesse processo, o ferro é oxidado facilmente quando exposto ao ar úmido (O2) e água (H2O). Essa oxidação gera o cátion Fe2+, formando o polo positivo (que perde elétrons) da pilha.
b) Enquanto os cátions Fe2+ migram para o polo positivo (ânodo), os ânions OH– migram para o polo negativo (cátodo) e ocorre a formação do hidróxido ferroso (Fe(OH)2).
c) Concreto armado de construções pode sofrer corrosão. Em sua estrutura existem constituintes que são decompostos por ácidos, como mostrado na seguinte reação:
3CaO.2SiO2.3H2O + 2NH3 → 3CaO + 2SiO2 + 6H2O + N2.
d) Na presença de oxigênio, o Fe(OH)2 é oxidado a hidróxido de ferro III (Fe(OH)3), que depois perde água e se transforma no óxido de ferro (III) mono-hidratado (Fe2O3.H2O), de coloração castanho-avermelhada, isto é, a ferrugem que conhecemos.
Letra D.
Confira a ilustração a seguir:
-
Questão 4
(Unicamp) Para ser usado em um implante dentário, um metal ou liga precisa apresentar excelente compatibilidade com o organismo, alta resistência mecânica e boa flexibilidade, entre outros atributos. Imagine que dois metais, A e B, tenham sido testados quanto à sua aplicação em um implante, e o metal A foi considerado a melhor opção.
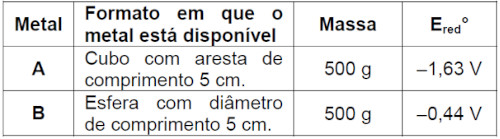
Esse resultado é compatível com o fato de que o metal A tem:
a) menor densidade, embora seja menos resistente à corrosão.
b) menor densidade e é mais resistente à corrosão.
c) maior densidade, embora seja menos resistente à corrosão.
d) maior densidade e é mais resistente à corrosão.
-
Questão 5
(UFPR) Num laboratório, um grupo de alunos possui quatro semicélulas montadas, todas em condição padrão de concentração e temperatura, correspondentes às semirreações mostradas no quadro abaixo:

Numa dada combinação para montar uma pilha eletroquímica, o valor de diferença de potencial (ΔE) da pilha, no instante em que se ligaram os contatos, foi de 0,69 V.
A combinação utilizada nessa pilha foi entre as semicélulas:
a) I e II.
b) I e III.
c) I e IV.
d) II e III.
e) III e IV.
Letra A. A pilha foi montanda entre as semicélulas de números I e II:
DDP = Eº maior – Eº menor
DDP = +1,23 V – (+0,54 V)
DDP = +1,23 V – 0,54 V
DDP = +0,69 V
-
Questão 6
(Enem) Os tanques de armazenamento de gasolina podem, com o tempo, sofrer processos oxidativos, resultando na contaminação do combustível e do solo à sua volta. Uma forma de evitar tais problemas econômicos e ambientais é utilizar preferencialmente metais de sacrifício, protegendo os tanques de armazenamento. Suponha que seja necessário usar um metal de sacrifício em um tanque de aço (liga de ferro-carbono). Considere as semirreações de redução e seus respectivos potenciais padrão.
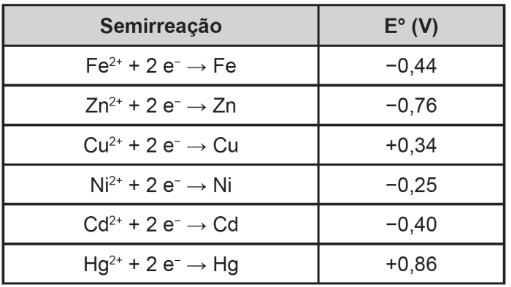
Dos metais citados, o que garantirá proteção ao tanque de aço é o
a) zinco.
b) cobre.
c) níquel.
d) cádmio.
e) mercúrio.
-
Questão 7
(Unirv – adaptada) As reações de oxirredução permitiram o desenvolvimento das pilhas e, por sua vez, dos aparelhos eletrônicos portáteis. A tabela a seguir mostra a combinação de alguns pares de eletrodos com seu respectivo potencial de redução.

Baseando-se na tabela, qual é a alternativa incorreta?
a) Na combinação 1, o eletrodo de cálcio será o ânodo.
b) Na combinação 1, a força eletromotriz será maior que 2,10 V.
c) Na combinação 2, o eletrodo de cádmio será o cátodo.
d) Na combinação 2, a força eletromotriz será maior que 1,84 V.
Letra C. Na combinação 1, o eletrodo de cálcio será o ânodo, pois ele possui menor potencial de redução, então sofrerá oxidação.
Na combinação 1, a força eletromotriz será maior que 2,10 V.
DDP = Eº maior – Eº menor
DDP = -0,76V – (-2,87 V)
DDP = -0,76V + 2,87 V
DDP = +2,10 V
Na combinação 2, a força eletromotriz será maior que 1,84 V.
DDP = Eº maior – Eº menor
DDP = +1,84V – (-0,40 V)
DDP = +1,84V + 0,40 V
DDP = +2,24 V
-
Questão 8
(Unirv – adaptada) Considerando as semirreações com os respectivos potenciais de oxidação (em volts) e o esquema a seguir:
Zn(s) → 2e– + Zn2+ E = +0,76
Ni(s) → 2e– + Ni2+ E = +0,24
Pb(s) → 2e– + Pb2+ E = +0,13
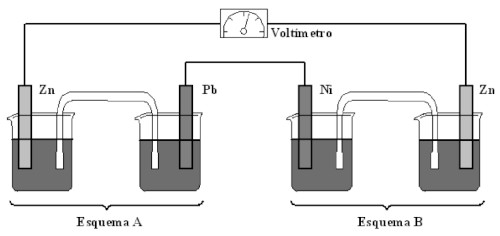
Os béqueres apresentam soluções dos respectivos íons dos eletrodos. Assinale V (verdadeiro) ou F (falso) para as alternativas.
a) A força eletromotriz do esquema A isolado é igual a +0,63 V.
b) A força eletromotriz do esquema B isolado é igual a +0,52 V.
c) A força eletromotriz total como ilustrado é igual a +1,15 V.
d) A ponte salina do esquema A só pode ser feita usando sais de Zn ou de Pb.
As alternativas A e B são verdadeiras, e as alternativas C e D são falsas.
A força eletromotriz do esquema A isolado é igual a +0,63 V.
DDP = Eº maior – Eº menor
DDP = +0,76 V – (+0,13 V)
DDP = +0,76 V – 0,13 V
DDP = +0,63 V
A força eletromotriz do esquema B isolado é igual a +0,52 V.
DDP = Eº maior – Eº menor
DDP = +0,76 V – (+0,24 V)
DDP = +0,76 V – 0,24 V
DDP = +0,52 V
-
Questão 9
(UECE)
Entre as diversas aplicações da eletrólise, encontra-se a galvanização. O nome do processo é uma homenagem ao médico, físico e filósofo italiano Luigi Galvani (1737-1798). Considerando o processo de galvanização, analise as seguintes proposições:
I. É a aplicação de uma camada de cobre ou ligas de cobre sobre a superfície de aço ou ferro.
II. A finalidade da galvanização é formar uma capa protetora que evite a corrosão do metal.
III. O método de galvanização mais usado é o de imersão a quente.
IV. O metal utilizado na galvanização é conhecido como metal de sacrifício e tem maior poder de redução que o metal a ser protegido.
São verdadeiras somente as proposições
a) I e III.
b) I e IV.
c) II e IV.
d) II e III.
Letra D. I. Falsa. O metal mais utilizado no processo de galvanização é o zinco.
IV. Falsa. O metal utilizado na galvanização é conhecido como metal de sacrifício e tem menor poder de redução que o metal a ser protegido.
-
Questão 10
(Enem 2019) Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando à produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.
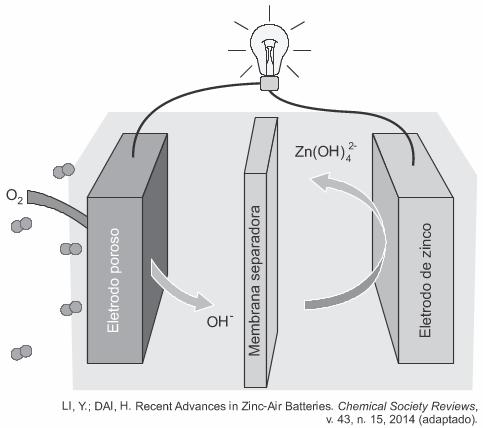
No funcionamento da bateria, a espécie química formada no ânodo é
a) H2 (g).
b) O2 (g).
c) H2O (l).
d) OH− (aq).
e) Zn(OH)42- (aq).
Letra E. Observe na imagem que os íons OH- passam pela membrana que separa os eletrodos e soluções, o que gerará reações paralelas. Portanto, a espécie química formada no ânodo será o Zn(OH)42-.
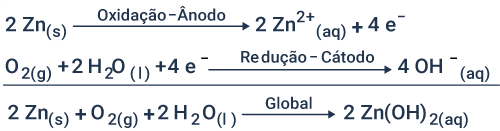
Reações que ocorrem em paralelo:
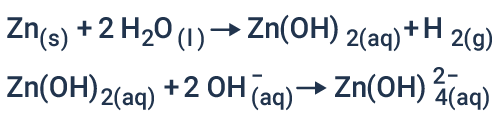
-
Questão 11
(Enem 2018) Em 1938 o arqueólogo alemão Wilhelm König, diretor do Museu Nacional do Iraque, encontrou um objeto estranho na coleção da instituição, que poderia ter sido usado como uma pilha, similar às utilizadas em nossos dias. A suposta pilha, datada de cerca de 200 a.C., é constituída de um pequeno vaso de barro (argila) no qual foram instalados um tubo de cobre, uma barra de ferro (aparentemente corroída por ácido) e uma tampa de betume (asfalto), conforme ilustrado.
Considere os potenciais-padrão de redução: Eᶿ(Fe²⁺|Fe) = – 0,44 V; Eᶿ(H⁺|H2) = 0,00 V; e Eᶿ(Cu²⁺|Cu) = +0,34 V.
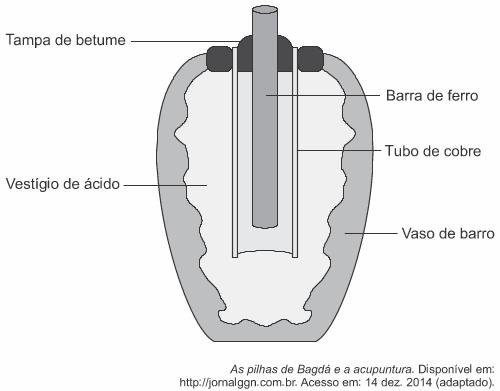
Nessa suposta pilha, qual dos componentes atuaria como cátodo?
a) A tampa de betume.
b) O vestígio de ácido.
c) A barra de ferro.
d) O tubo de cobre.
e) O vaso de barro.
Letra D. Através da observação dos potenciais de redução, podemos afirmar que o Fe sofrerá oxidação (ânodo), pois possui menor potencial, e o cobre sofrerá redução (cátodo), pois possui maior potencial.
-
Questão 12
(Enem 2018) Células solares à base de TiO2 sensibilizadas por corantes (S) são promissoras e poderão vir a substituir as células de silício. Nessas células, o corante adsorvido sobre o TiO2 é responsável por absorver a energia luminosa (hv), e o corante excitado (S*) é capaz de transferir elétrons para o TiO2.
Um esquema dessa célula e os processos envolvidos estão ilustrados na figura. A conversão de energia solar em elétrica ocorre por meio da sequência de reações apresentadas.
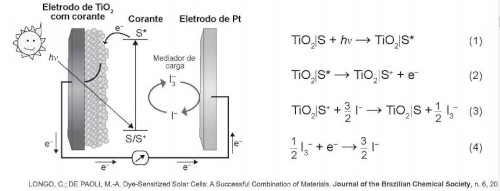
A reação 3 é fundamental para o contínuo funcionamento da célula solar, pois:
a) reduz íons I- a I-3.
b) regenera o corante.
c) garante que a reação 4 ocorra.
d) promove a oxidação do corante.
e) transfere elétrons para o eletrodo de TiO2.
Letra B. Note que na primeira equação temos o corante adsorvido sobre o TiO2, que posteriormente sofre oxidação, como demonstrado na equação 2. Na equação 3, o corante adsorvido sobre o TiO2 é regenerado e isso é fundamental, pois o corante adsorvido é o responsável por absorver a energia luminosa.
-
Questão 13
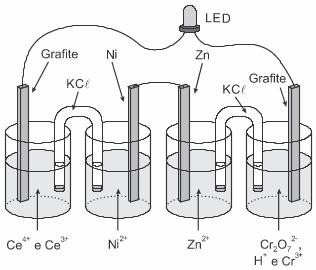
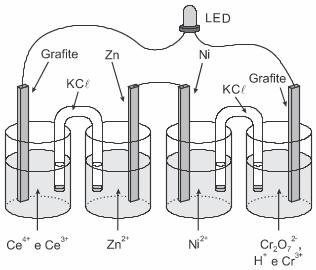
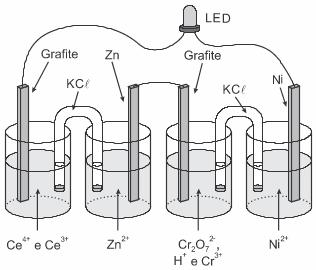
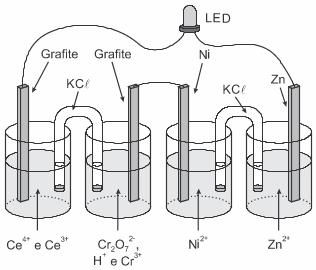
(Enem 2017) A invenção do LED azul, que permite a geração de outras cores para compor a luz branca, possibilitou a construção de lâmpadas energeticamente mais eficientes e mais duráveis do que as incandescentes e fluorescentes. Em um experimento de laboratório, pretende-se associar duas pilhas em série para acender um LED azul que requer 3,6 volts para o seu funcionamento.
Considere as semirreações de redução e seus respectivos potenciais mostrados no quadro.

Qual associação em série de pilhas fornece diferença de potencial, nas condições padrão, suficiente para acender o LED azul?
a)
b)
c)
d)
e)
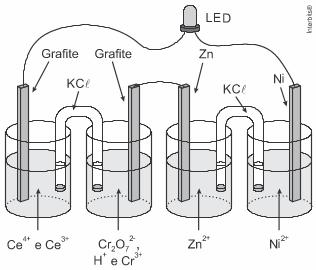
Letra C. A maior diferença de potencial que pode ser gerada a partir da observação e combinação dos metais fornecidos é entre cério e zinco:
DDP = Eº maior – Eº menor
DDP = +1,61 V – (-0,76 V)
DDP = +1,61 V + 0,76 V
DDP = +2,37 V
A menor diferença de potencial que pode ser gerada a partir da observação e combinação dos metais fornecidos é entre dicromato e níquel.
DDP = Eº maior – Eº menor
DDP = +1,33 V – (-0,25 V)
DDP = +1,33 V + 0,25 V
DDP = +1,58 V
DDP em série = +2,37 V + (+1,58 V)
DDP em série = +3,95 V é maior que 3,60 V, portanto o LED acende.
-
Questão 14
(Enem 2016)
Texto I
Biocélulas combustíveis são uma alternativa tecnológica para substituição das baterias convencionais. Em uma biocélula microbiológica, bactérias catalisam reações de oxidação de substratos orgânicos. Liberam elétrons produzidos na respiração celular para um eletrodo, onde fluem por um circuito externo até o cátodo do sistema, produzindo corrente elétrica. Uma reação típica que ocorre em biocélulas microbiológicas utiliza o acetato como substrato.
AQUINO NETO. S. Preparação e caracterização de bioanodos para biocélula e combustível etanol/O2 Disponível em: www.teses.usp.br. Acesso em: 23 jun. 2015 (adaptado).
Texto II
Em sistemas bioeletroquímicos, os potenciais padrão (E°’) apresentam valores característicos. Para as biocélulas de acetato, considere as seguintes semirreações de redução e seus respectivos potenciais:
2 CO2 + 7H+ + 8e– → CH3COO– + 2H2O E°’ = -0,3 V
O2 + 4H+ + 4e– → 2H2O E°’ = 0,8 V
Nessas condições, qual é o número mínimo de biocélulas de acetato, ligadas em série, necessárias para se obter uma diferença de potencial de 4,4 V?
a) 3
b) 4
c) 6
d) 9
e) 15
Letra B.
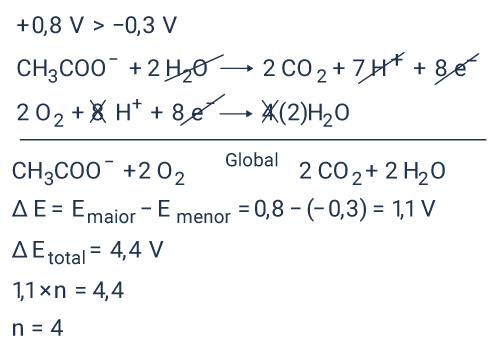
-
Questão 15
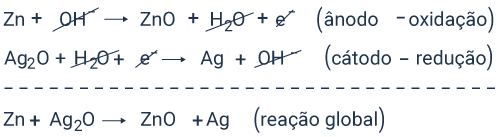
(Enem cancelado 2009) Pilhas e baterias são dispositivos tão comuns em nossa sociedade que, sem percebermos, carregamos vários deles junto ao nosso corpo; elas estão presentes em aparelhos de MP3, relógios, rádios, celulares etc. As semirreações descritas a seguir ilustram o que ocorre em uma pilha de óxido de prata.
Zn (s) + OH- (aq) → ZnO (s) + H2O (l) + e-
Ag2O (s) + H2O (l) + e- → Ag (s) + OH- (aq)
Pode-se afirmar que esta pilha:
a) é uma pilha ácida.
b) apresenta o óxido de prata como o ânodo.
c) apresenta o zinco como o agente oxidante.
d) tem como reação da célula a seguinte reação: Zn(s) + Ag2O(s) → ZnO(s) + 2Ag(s).
e) apresenta fluxo de elétrons na pilha do eletrodo de Ag2O para o Zn.
Letra D.
-
Questão 16
(Enem PPL 2013) O Instituto Luiz Coimbra (UFRJ) lançou o primeiro ônibus urbano movido a hidrogênio do Hemisfério Sul, com tecnologia inteiramente nacional. Sua tração provém de três fontes de energia, sendo uma delas a pilha de combustível, na qual o hidrogênio, gerado por um processo eletroquímico, reage com o oxigênio do ar, formando água.
FRAGA, I. Disponível em: http://cienciahoje.uol.com.br. Acesso em: 20 jul. 2010 (adaptado).
A transformação de energia que ocorre na pilha de combustível responsável pelo movimento do ônibus decorre da energia cinética oriunda do(a):
a) calor absorvido na produção de água.
b) expansão gasosa causada pela produção de água.
c) calor liberado pela reação entre o hidrogênio e o oxigênio.
d) contração gasosa causada pela reação entre o hidrogênio e o oxigênio.
e) eletricidade gerada pela reação de oxirredução do hidrogênio com o oxigênio.
Letra E.
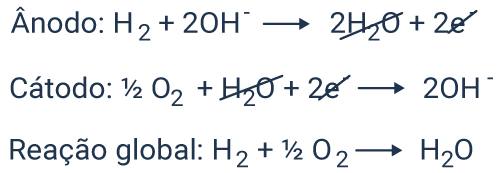
O ônibus entrará em movimento por conta da eletricidade gerada pela reação de oxirredução entre o hidrogênio e o oxigênio.
-
Questão 17
(Enem PPL 2011) Iniciativas do poder público para prevenir o uso de bebidas alcoólicas por motoristas, causa de muitos acidentes nas estradas do país, trouxeram à ordem do dia, não sem suscitar polêmica, o instrumento popularmente conhecido como bafômetro. Do ponto de vista de detecção e medição, os instrumentos normalmente usados pelas polícias rodoviárias do Brasil e de outros países utilizam o ar que os “suspeitos” sopram para dentro do aparelho, através de um tubo descartável, para promover a oxidação do etanol a etanal. O método baseia-se no princípio da pilha de combustível: o etanol é oxidado em meio ácido sobre um disco plástico poroso coberto com pó de platina (catalisador) e umedecido com ácido sulfúrico, sendo um eletrodo conectado a cada lado desse disco poroso. A corrente elétrica produzida, proporcional à concentração de álcool no ar expirado dos pulmões da pessoa testada, é lida numa escala que é proporcional ao teor de álcool no sangue. O esquema de funcionamento desse detector de etanol pode ser visto na figura.
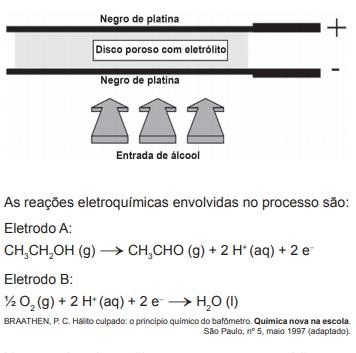
No estudo das pilhas, empregam-se códigos e nomenclaturas próprias da Química, visando caracterizar os materiais, as reações e os processos envolvidos.
Nesse contexto, a pilha que compõe o bafômetro apresenta o:
a) eletrodo A como cátodo.
b) etanol como agente oxidante.
c) eletrodo B como polo positivo.
d) gás oxigênio como agente redutor.
e) fluxo de elétrons do eletrodo B para o eletrodo A.
Letra C.
-
Eletrodo A:
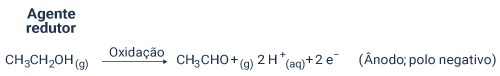
-
Eletrodo B:
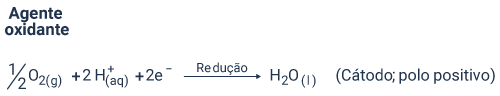
Fluxo de elétrons: do ânodo A para o cátodo B.
-
-
Questão 18
(Fuvest 2019) Considerando que baterias de Li‐FeS2 podem gerar uma voltagem nominal de 1,5 V, o que as torna úteis no cotidiano e que a primeira reação de descarga dessas baterias é 2 Li + FeS2 → Li2FeS2, é correto afirmar:
a) O lítio metálico é oxidado na primeira descarga.
b) O ferro é oxidado e o lítio é reduzido na primeira descarga.
c) O lítio é o cátodo dessa bateria.
d) A primeira reação de descarga forma lítio metálico.
e) O lítio metálico e o dissulfeto ferroso estão em contato direto dentro da bateria.
Letra A. O nox do lítio nos reagentes é 0 e passou a ser +1 nos produtos.