Exercícios sobre Leis Ponderais
As Leis Ponderais são leis quantitativas, que genericamente relacionam as massas de substâncias que estão participando de uma reação.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Ao se passar uma corrente contínua na água (eletrólise), ela é decomposta em seus constituintes: hidrogênio e oxigênio. Os dados experimentais mostram que as massas dessas duas substâncias sempre estarão na mesma proporção de 1:8, seguindo a Lei Ponderal de Proust. Essas reações também seguem a lei de Lavoisier, isto é, a massa no sistema permanece constante.
Com base nessas leis, indique a alternativa que traz os respectivos valores das massas (em gramas) que substituiriam corretamente as letras A, B, C e D nesses experimentos:
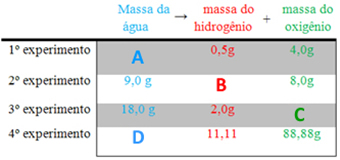
-
4,5/ 1,0/ 16,0/ 99,99.
-
3,5/ 0,1/ 20,0/ 8,0.
-
5,0/ 17,0/ 28,0/ 8,8.
-
6,0/2,0/ 16,0/ 8,0.
-
4,5 1,0/ 20,0/8,8.
Alternativa “a”.
Lembrando que a proporção que se segue é de 1/8 e que a soma das massas dos reagentes (hidrogênio + oxigênio) tem que ser igual à massa do produto (água), temos:
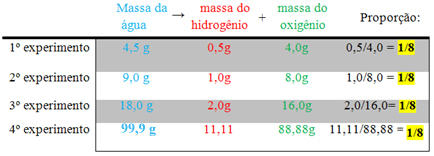
-
-
Questão 2
Lavoisier foi o primeiro cientista a determinar que o ar era constituído por uma mistura de dois gases: 21% de oxigênio e 79% de azoto (não permite a existência de vida: azoo = não vida). Esse gás é conhecido atualmente como:
-
Hidrogênio
-
Nitrogênio
-
Amônia
-
Gás carbônico.
-
Cloro.
Alternativa “b”.
-
-
Questão 3
(FCMSC-SP) A frase: “Do nada, nada; em nada, nada pode transformar-se” relaciona-se com as ideias de:
-
Dalton.
-
Proust.
-
Boyle.
-
Lavoisier.
-
Gay-Lussac.
Alternativa “d”.
-
-
Questão 4
(UFMG) Considere as seguintes reações químicas, que ocorrem em recipientes abertos, colocados sobre uma balança:
I - Reação de bicarbonato de sódio com vinagre, em um copo.
II - Queima de álcool, em um vidro de relógio.
III - Enferrujamento de um prego de ferro, colocado sobre um vidro de relógio.
IV - Dissolução de um comprimido efervescente, em um copo com água.
Em todos os exemplos, durante a reação química, a balança indicará uma diminuição da massa contida no recipiente, exceto em:
a) IIIb) IV
c) I
d) II
Alternativa “a”.
O enferrujamento do ferro pode ser considerado uma reação de síntese, na qual o ferro metálico reage com o oxigênio e o vapor de água do ar atmosférico, formando óxidos e hidróxidos de ferro. Como os reagentes gasosos foram incorporados ao produto sólido final e a reação ocorre em recipiente aberto, a massa apontada na balança ao término da reação é maior que a inicial.