Exercícios sobre Ligações Covalentes
Teste os seus conhecimentos: Faça exercícios sobre Ligações Covalentes e veja a resolução comentada.
Publicado por: Líria Alves de SouzaQuestões
-
Questão 1
(FEEQ – CE)
O selênio e o enxofre pertencem à família VI A da tabela periódica. Sendo assim, o seleneto e o sulfeto de hidrogênio são representados, respectivamente pelas fórmulas:
a) HSe e HS
b) H2Se e HS
c) HSe e H2S
d) H2Se e H2S
e) H3Se e H3S
Alternativa D.
A relação entre a posição na Tabela periódica e o número de ligações estabelece que os componentes da família VI A possuam 6 elétrons na camada de valência, sendo que apenas 2 elétrons podem ser usados para formar ligações covalentes. Assim sendo, o Selênio e o Enxofre precisam compartilhar dois átomos em suas ligações. Como o Hidrogênio compartilha apenas 1 elétron, é preciso dois átomos de H para formar o seleneto (H2Se) e o sulfeto de hidrogênio (H2S).
-
Questão 2
(FUVEST-SP)
Considere o elemento cloro formando compostos com, respectivamente, hidrogênio, carbono, sódio e cálcio. (Consulte a tabela periódica.). Com quais desses elementos o cloro forma compostos covalentes?
Hidrogênio e carbono.
Os compostos covalentes se formam através da união entre átomos de hidrogênio, ametais ou semimetais. O cloro (Cl) se classifica na Tabela Periódica como sendo um ametal, como também o carbono (C). Tanto o sódio (Na) como o cálcio (Ca) são metais e por isso não estabelecem ligação covalente com o cloro
-
Questão 3
(UNI-RIO)
O dióxido de carbono (CO2) é um gás essencial no globo terrestre. Sem a presença desse gás, o globo seria gelado e vazio. Porém, quando ele é inalado em concentração superior a 10%, pode levar o indivíduo à morte por asfixia. Esse gás apresenta em sua molécula um número de ligações covalentes igual a:
a) 4
b) 1
c) 2
d) 3
e) 0
- O carbono, membro da família IV A, pode compartilhar 4 elétrons para formar ligações.
- O oxigênio pertence à família VI A, portanto possui 6 elétrons na camada de valência, podendo compartilhar 2 desses elétrons para formar ligações covalentes.
O ═ C ═ O
Cada ligação dupla representa duas ligações covalentes, como são duas ligações ═, temos no total 4 ligações covalentes.
-
Questão 4
(FUVEST)
As unidades constituintes dos sólidos: óxido de magnésio (MgO), iodo (I2) e platina (Pt) são, respectivamente:
a) átomos, íons e moléculas;
b) íons, átomos e moléculas;
c) íons, moléculas e átomos
d) moléculas, átomos e íons;
e) moléculas, íons e átomos.
Alternativa C.
- Óxido de magnésio se forma a partir de uma ligação iônica: Mg+O-, portanto o sólido é constituído por íons.
- O sólido I2 corresponde a uma unidade de moléculas de Iodo.
- O símbolo Pt indica a presença de apenas 1 átomo de platina.
-
Questão 5
O cloreto de sódio (NaCl), o pentano (C5H12) e álcool comum (CH3 CH2OH) têm suas estruturas constituídas , respectivamente, por ligações:
a) iônicas, covalentes e covalentes
b) covalentes, covalentes e covalentes
c) iônicas, covalentes e iônicas
d) covalentes, iônicas e iônicas
e) iônicas, iônicas e iônicas
Cloreto de sódio → ligação iônica: Na+Cl-
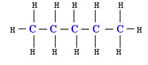
Pentano → ligação covalente entre átomos de carbono e hidrogênios.
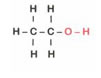
Álcool comum → ligação covalente entre carbonos, oxigênio e hidrogênios.