Exercícios sobre mistura de soluções sem reação
Misturou-se 1 L de uma solução aquosa de cloreto de sódio (NaCl) 0,1 mol/L a 1 L de uma solução aquosa de cloreto de sódio (NaCl) 0,2 mol/L, obtendo-se uma nova solução aquosa com volume igual a 2 L. A partir desses dados, determine qual alternativa corresponde corretamente à concentração em quantidade de matéria (em mol/L) da nova solução obtida:
-
1,0
-
2,0
-
0,15
-
0,3
-
0,25
Alternativa “c”.
M1 . V1 + M2 . V2 = M . V
(0,1 mol/L) . (1 L) + (0,2 mol/L) . (1 L) = M . 2 L
0,1 mol + 0,2 mol = M . 2 L
M = (0,1 + 0,2) mol
2 L
M = 0,15 mol/L
Para originar uma solução de concentração igual a 120 g/L, qual é o volume em litros de uma solução de CaCl2 de concentração 200 g/L que deve ser misturado a 200 mL de uma outra solução aquosa de CaCl2 de concentração igual a 100 g/L?
-
0,05
-
50
-
296,25
-
0,296
-
0,3
Alternativa “a”.
Dados:
C1 = 200 g/L
V1 = ?
C2 = 100 g/L
V2 = 200 mL = 0,2 L
C = 120 g/L
V = V1 + V2 = V1 + 0,2
C1 . V1 + C2 . V2 = C . V
200 . V1 + 100 . 0,2 = 120 . (V1 + 0,2)
200 V1 + 20 = 120 V1 + 24
200 V1 -120 V1 = 24 – 20
80 V1 = 4
V1 = 4/80
V1 = 0,05 L
(UFMG) O quadro abaixo representa as quantidades utilizadas na preparação de três soluções aquosas de permanganato de potássio (KMnO4).
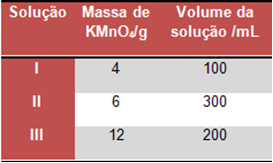
Analise o quadro quanto às concentrações das soluções e assinale a alternativa correta.
-
Se adicionarmos a solução II à solução III, a concentração final será menor que a da solução I.
-
Se adicionarmos 100 mL de água à solução I, a concentração final será a mesma da solução III.
-
A solução mais concentrada é a que tem o menor volume.
-
A solução mais diluída é a que tem a maior massa do soluto.
Alternativa “a”.
Solução I:
4 g de KMnO4 --------- 0,1 L de solução
XI ------------------------- 1 L de solução
XI = 1 . 4/ 0,1
XI = 40 g/L de KMnO4
Solução II:
6 g de KMnO4 --------- 0,3 L de solução
XII ------------------------- 1 L de solução
XII = 1 . 6/ 0,3
XII = 20 g/L de KMnO4
Solução III:
12 g de KMnO4 --------- 0,2 L de solução
XIII ------------------------- 1 L de solução
XIII = 1 . 12/ 0,2
XIII = 60 g/L de KMnO4
Analisando as alternativas, temos:
a) A adição da solução II à solução III:
Massa do soluto = 6 + 12 = 18 g
Volume final da mistura = 300 + 200 = 500 mL = 0,5 L
18 g de KMnO4 --------- 0,5 L de solução
X ------------------------- 1 L de solução
X = 1 . 18/ 0,5
X = 36 g/L de KMnO4
A concentração em massa da mistura das soluções II e III é, de fato, menor que a concentração em massa da solução I.
b) Considerando a aditividade de volume, temos:
Massa do soluto = 4 g
Volume final da mistura = 100 + 100 = 200 mL = 0,2 L
4 g de KMnO4 --------- 0,2 L de solução
X ------------------------- 1 L de solução
X = 1 . 4/ 0,2
X = 20 g/L de KMnO4
A afirmação é incorreta, pois a concentração da solução III é igual a 60 g/L.
c) A solução mais concentrada é a que apresenta a maior relação entre soluto e solvente, no caso, a solução III.
d) A solução mais diluída é a que apresenta a menor relação entre soluto e solvente, no caso, a solução II.
(UFRN) Misturando-se 100 mL de uma solução aquosa 0,10 mol/L de NaCl com 100 mL de uma solução aquosa 0,1 molar de KCl , a solução resultante deverá apresentar concentrações molares de Na+, K+ e Cl- respectivamente iguais a:
a) 0,05; 0,05; 0,10
b) 0,10; 0,10; 0,10
c) 0,10; 0,10; 0,20
d) 0,10; 0,20; 0,10
e) 0,20; 0,20; 0,10
Alternativa “a”.
O volume final é V = 100 + 100 = 200 mL = 0,2 L
nº de mols de NaCl = 0,1 . 0,1 = 0,01 mol NaCl
0,01 mol de NaCl → 0,01 mol de Na¹++ e 0,01 mol de Cl¹-
nº de mols de KCl = 0,1 x 0,1 = 0,01 mol de KCl
0,01 mol de KCl → 0,01 mol de K¹++ e 0,01 mol de Cl¹-
As concentrações molares de cada um dos íons são:
[Na¹+] = 0,01 / 0,2 = 0,05 mol/L
[K¹+] = 0,01 / 0,02 = 0,05 mol/L
[Cl¹-] = (0,01 + 0,01) / 0,2 = 0,1 mol/L






