Exercícios sobre Mol e Número de Avogadro
Estes exercícios sobre mol e número de Avogadro exigem que se conheça a relação que estabelece que 1 mol de qualquer substância apresenta 6,0 . 1023 partículas constituintes.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Sabendo que a massa atômica do magnésio é igual a 24 u, determine a massa, em gramas, de um átomo desse elemento. (Dado: Número de Avogadro = 6,0 . 1023).
a) 24 g.
b) 4,0 g.
c) 24 . 10-23 g.
d) 4,0 . 1023 g.
e) 4,0 . 10-23 g.
Alternativa “e”.
1 mol de átomos de Mg ↔ 24 g/mol ↔ 6,0 . 1023 átomos/mol
x = 1 átomo . 24 g/mol
6,0 . 1023 átomos/molx = 4,0 . 10-23 g.
-
Questão 2
Considere um copo que contém 180 mL de água. Determine, respectivamente, o número de mol de moléculas de água, o número de moléculas de água e o número total de átomos (Massas atômicas = H = 1,0; O = 16; Número de Avogadro = 6,0 . 1023; densidade da água =1,0 g/mL).
a) 10 mol, 6,0 . 1024 moléculas de água e 18 . 1024 átomos.
b) 5 mol, 6,0 . 1024 moléculas de água e 18 . 1024 átomos.
c) 10 mol, 5,0 . 1023 moléculas de água e 15 . 1024 átomos.
d) 18 mol, 6,0 . 1024 moléculas de água e 18 . 1024 átomos.
e) 20 mol, 12 . 1024 moléculas de água e 36 . 1024 átomos.
Alternativa “a”.
A massa molar da água é igual a 18 g/mol. Visto que a densidade da água é igual a 1,0 g/mL, em 180 mL de água, temos 180 g:
d = m
vm = d . v
m = (1,0 g/mL) . 180 mL
m = 180 g
Assim, temos:
1 mol de moléculas de água ------ 18 g/mol
n --------------------- 180 gn = 180/18
n = 10 mol de moléculas de água
* Agora vamos determinar o número de moléculas de água:
18 g/mol ------- 6,0 . 1023 moléculas/mol
180 g----------- x
x = 180 . 6,0 . 1023
18x = 60 . 1023 = 6,0 . 1024 moléculas de água.
* Determinação da quantidade total de átomos:
1 molécula de água (H2O) ----- 3 átomos
6,0 . 1024 moléculas/mol ------ yy = (6,0 . 1024 ) . 3
y = 18,0 . 1024 átomos
-
Questão 3
(UNB) Os microprocessadores atuais são muito pequenos e substituíram enormes placas contendo inúmeras válvulas. Eles são organizados de forma que apresentem determinadas respostas ao serem percorridos por um impulso elétrico. Só é possível a construção de dispositivos tão pequenos devido ao diminuto tamanho dos átomos. Sendo estes muito pequenos, é impossível contá-los. A constante de Avogadro - e não o número de Avogadro - permite que se calcule o número de entidades - átomos, moléculas, formas unitárias, etc. - presentes em uma dada amostra de substância. O valor dessa constante, medido experimentalmente, é igual a 6,02 . 1023 mol-1. Com relação ao assunto, julgue os seguintes itens.
(01) A constante de Avogadro é uma grandeza, sendo, portanto, um número (6,02 . 1023) multiplicado por uma unidade de medida (mol-1).
(02) A constante de Avogadro, por ser uma grandeza determinada experimentalmente, pode ter seu valor alterado em função do avanço tecnológico.
(03) Massas iguais de diferentes elementos químicos contêm o mesmo número de átomos.
(04) Entre os elementos químicos, o único que, em princípio, não está sujeito a uma variação de massa atômica é o isótopo do carbono de massa 12,00 u.
(01) Verdadeiro.
(02) Verdadeiro.
(03) Falso. Os átomos de diferentes elementos químicos possuem massas atômicas diferentes. Assim, se pegarmos massas iguais de diferentes elementos químicos, o número de átomos de cada elemento químico nessas massas será diferente (comparando massas iguais, quanto menor a massa atômica do elemento, maior o número de átomos desse elemento nessa massa).
(04) Verdadeiro.
-
Questão 4
(Fuvest-SP) A tabela abaixo apresenta o mol, em gramas, de várias substâncias:
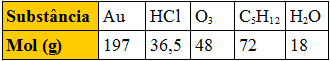
Tabela com mol de substânciasComparando massas iguais dessas substâncias, a que apresenta maior número de moléculas é:
a) Au
b) HCl
c) O3
d) C5H10
e) H2O
Alternativa “e”.
De acordo com a constante de Avogadro, terá maior número de moléculas a substância que tiver a maior quantidade de mols. Considerando que a quantidade de mols pode ser obtida por m/M, concluímos que, em igualdade de massa (m), a substância que tiver menor massa molar (M) terá maior número de moléculas. A que tem menor massa molar é a água (H2O).