Exercícios sobre os nêutrons
Estes exercícios tratam sobre os nêutrons, as características, o descobridor e as formas utilizadas para determinar a quantidade dessas partículas no interior do núcleo do átomo.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
As ideias de diferentes cientistas tiveram uma grande contribuição para a moderna teoria atômica. Muito do que se conhece hoje sobre o átomo partiu de propostas modestas, influenciadas pela disponibilidade de tecnologias ainda limitadas.
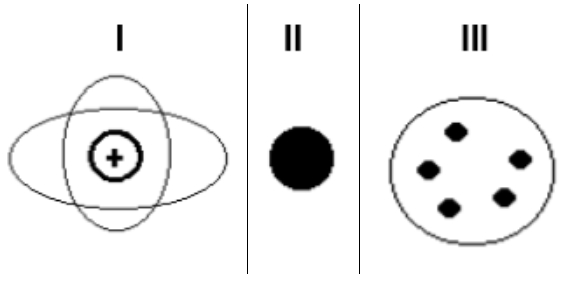
As figuras indicadas acima (I, II, e III), por exemplo, indicam os primeiros modelos atômicos propostos, porém nenhum deles pertence ao cientista denominado:
a) Thompson
b) Dalton
c) Rutherford
d) Chadwick
Letra d). Os modelos propostos não pertencem ao cientista Chadwick, pois ele descobriu a partícula sem carga denominada nêutron (presente no núcleo do átomo) e não desenvolveu nenhum modelo atômico.
Thompson: desenvolveu o modelo do pudim com passas (figura III).
Dalton: desenvolveu o modelo da bola de bilhar (figura II).
Rutherford: desenvolveu o modelo do sistema solar (figura I).
-
Questão 2
Quando realizamos um cálculo utilizando a diferença entre o número de massa de um átomo e o seu número de prótons, estamos determinando a quantidade de:
a) prótons.
b) nêutrons.
c) elétrons.
d) mésons.
e) pósitrons.
Letra b). O enunciado cita o número de massa (representado por A) e o número de prótons (representado por p), os quais participam da seguinte expressão matemática:
A = p + n
Nessa expressão, aparece o número de nêutrons, assim, isolando o número de massa e de prótons, podemos determinar o número de nêutrons.
n = A - p
-
Questão 3
(UCS-RS) O conhecimento das partículas subatômicas, bem como do seu número, é útil para a compreensão das propriedades individuais dos átomos. Os átomos distinguem-se uns dos outros pelo número de prótons e de nêutrons que contêm. Com relação ao átomo de boro (5B11), é correto afirmar que ele distingue dos demais átomos por possuir…
a) 5 prótons e 6 nêutrons.
b) o número atômico e o número de nêutrons iguais a 6.
c) o número atômico e o número de nêutrons iguais a 5.
d) número igual de prótons e nêutrons.
e) 11 prótons e 5 nêutrons.
Letra a).
O exercício forneceu a sigla 5B11, que contém os seguintes valores:
-
Número atômico (Z) = 5 (está embaixo, à esquerda);
-
Número de prótons (p) = 5 (é sempre igual ao número de prótons);
-
Número de elétrons (e) = 5 (é igual ao número de prótons, caso o átomo em questão não seja um íon);
-
Número de massa (A) = 11; é a resultante da soma do número prótons com o número de nêutrons (n);
-
Número de nêutrons = 6, o qual é sempre utilizado pela expressão:
A = p + n
-
-
Questão 4
(UFS-SE) O átomo xA2x é isóbaro do 28Ni58. O número de nêutrons em A é:
a) 28
b) 29
c) 30
d) 31
e) 32
Letra b). O exercício informa que os dois átomos são isóbaros, ou seja, apresentam o mesmo número de massa (2x), e pede o número de nêutrons de A. Para tal, devemos realizar os seguintes passos:
-
Passo 1: Determinar o valor de x.
Como os átomos são isóbaros, isso quer dizer que a massa do átomo A (que é 2x) é igual ao número de massa de B (que é 28), logo:
2x = 58
x = 28
2x = 29
-
Passo 2: substituir o valor de x e encontrar o número de massa e o número atômico do átomo A:
xA2x
Como o valor de x é 14, logo:
29A58
Passo 3: Determinar o número de nêutrons do átomo A, já que temos o seu número atômico e número de massa, na expressão abaixo:
A = Z + n
n = A – Z
n = 58 – 29
n = 29
-