Exercícios sobre pressão máxima de vapor em soluções
Nossos exercícios testarão seus conhecimentos sobre pressão máxima de vapor em soluções. Também disponibilizamos resoluções comentadas das questões.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Dadas as soluções aquosas de mesma concentração molar, as quais apresentam os seguintes solutos:
I. C6H12O6
II. C6H8O6
III. KNO3
IV. C63H88CoN14O14P
V. NaCl
As soluções que apresentam a menor pressão de vapor são, respectivamente:
a) I e II.
b) III e IV.
c) III e V.
d) II e V.
e) I e IV.
Letra c). Sempre que um soluto é adicionado a um solvente, ocorrem interações entre as moléculas do solvente e as do soluto, que passam a dificultar o processo de evaporação do solvente.
Essa dificuldade é maior nas soluções que apresentam solutos iônicos, pois eles se dissociam, ampliando o número de partículas, logo, o número de interações. Esse fato ocorre nos casos III e V (apresentam metais na sua composição).
Os solutos I, II e IV são moleculares, os quais não se dissociam em água, gerando um menor número de interações com o solvente.
-
Questão 2
Veja as soluções aquosas a seguir e suas respectivas concentrações:
I- 0,50 mol/L de C6H12O6
II- 0,15 mol/L de C6H12O6
III- 0,25 mol/L de C6H12O6
IV- 0,35 mol/L de C6H12O6
IV- 0,45 mol/L de C6H12O6
Marque a alternativa que apresenta a solução de maior e menor pressão de vapor respectivamente:
a) I e II
b) II e III
c) II e IV
d) II e I
e) V e III
Letra d). Observa-se no enunciado que todas as soluções apresentam o mesmo soluto, ou seja, a natureza delas não influencia a pressão máxima de vapor, apenas a concentração. Quando a análise da concentração é necessária, sempre devemos ter o seguinte raciocínio em mente: quanto maior a concentração, maior a quantidade de soluto; assim, menos o solvente evapora, e menor é a pressão máxima de vapor.
A solução II (concentração 0,15 mol/L) terá a maior pressão máxima de vapor, e a solução I (concentração 0,50 mol/L) terá a menor pressão máxima de vapor.
-
Questão 3
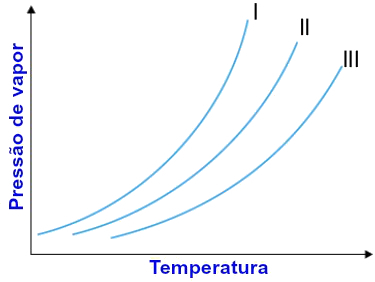
(PUC-MG) Os pontos normais de ebulição da água, do etanol e do éter etílico são, respectivamente, 100 oC, 78 oC e 34 oC. Observe as curvas, no gráfico, de variação da pressão de vapor líquido (Pv) em função da temperatura (T).
As curvas I, II e III correspondem, respectivamente, aos compostos:
a) éter etílico, etanol e água.
b) etanol, éter etílico e água.
c) água, etanol e éter etílico.
d) éter etílico, água e etanol.
e) água, éter etílico e etanol.
Letra a). A análise do gráfico envolvendo pressão de vapor e temperatura deve ser feita sempre da seguinte maneira: quanto mais próximo do eixo y (pressão de vapor), maior será a pressão e menor será o ponto de ebulição. Quanto mais distante, menor será a pressão e maior será o seu ponto de ebulição.
Com esse raciocínio, a curva I é que está mais próxima, e a curva III é a mais distante, logo, a I é o solvente éter (34oC) e a III é o solvente água (100oC). A curva II é o etanol (78o).
-
Questão 4
(UFSCar) As curvas de pressão de vapor, em função da temperatura, para um solvente puro, uma solução concentrada e uma solução diluída são apresentadas na figura a seguir:
Considerando que as soluções foram preparadas com o mesmo soluto não volátil, pode-se afirmar que as curvas do solvente puro, da solução concentrada e da solução diluída são, respectivamente:
a) I, II e III
b) I, III e II
c) II, III e I
d) II, I e III
e) III, II e I
Letra b). De acordo com a teoria sobre a pressão máxima de vapor, um solvente puro apresentará uma pressão máxima de vapor maior que a pressão do solvente na solução. Quanto maior a concentração da solução, menor será a pressão máxima de vapor.
-
Solvente puro: maior pressão;
-
Solução diluída: pressão menor que a do solvente puro e maior que a pressão do solvente na solução concentrada;
-
Solução concentrada: apresenta menor pressão do solvente.
A análise gráfica envolvendo pressão de vapor e temperatura deve ser feita sempre da seguinte maneira: quanto mais próximo do eixo y (pressão de vapor), maior será a pressão; quanto mais distante, menor será a pressão. Assim, podemos facilmente associar as curvas com o solvente das soluções fornecidas.
-
Solvente puro: curva I
-
Solução diluída: curva II
-
Solução concentrada: curva III
-
.jpg)