Exercícios sobre Reações de Neutralização
Uma reação de neutralização ocorre quando reagimos uma solução aquosa de um ácido e uma solução aquosa de uma base, obtendo a solução aquosa de um sal.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
O ácido fosfórico (H3PO4) é utilizado para as mais diversas finalidades, tais como remover ferrugens, na fabricação de vidro, na tinturaria, na produção de fertilizantes, nas indústrias alimentícias e farmacêuticas e, principalmente, como acidulante de refrigerantes, abaixando seu pH, regulando sua doçura, realçando o paladar e também atuando como conservante da bebida.
a) Equacione a reação de neutralização total do H3PO4 com solução aquosa de hidróxido de potássio (KOH).
b) Equacione as reações de neutralização parcial do H3PO4 com solução aquosa de hidróxido de potássio (KOH).
a) 1 H3PO4(aq) + 3 KOH(aq) → 1 K3PO4(aq) + 3 H2O(ℓ)
b) 1 H3PO4(aq) + 1 KOH(aq) → 1 KH2PO4(aq) + H2O(ℓ)
1 H3PO4(aq) + 2 KOH(aq) → 1 K2HPO4(aq) + 2 H2O(ℓ)
-
Questão 2
A seguir, temos várias reações não balanceadas. Qual delas não corresponde a uma reação de neutralização?
a) KOH(aq) + H2CO3(aq) → K2CO3(aq) + H2O(ℓ)
b) Ca(OH)2(aq) + 2 HF(aq) → CaF2(aq) + 2 H2O(ℓ)
c) CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(ℓ)
d) 2 HCl(aq) + Mg(OH)2(aq) → MgCl2(aq) + 2 H2O(ℓ)
e) H3PO4(aq) + NaOH(aq) → NaH2PO4(aq) + H2O(ℓ)
Alternativa “c”.
É a única alternativa em que os reagentes não são um ácido e uma base, além de não apresentar um sal como produto.
-
Questão 3
Equacione as reações de neutralização total entre os ácidos e as bases dados nos itens a seguir e indique qual é o nome do sal formado:
a) HNO3(aq)+ KOH(aq)
b) HCl(aq) + Ca(OH)2(aq)
c) H2SO4(aq)+ NaOH(aq)
d) H2SO4(aq)+ Mg(OH)2(aq)
e) H3PO4(aq)+ Ba(OH)2(aq)
a) HNO3(aq)+ KOH(aq) → KNO3(aq)+ H2O(ℓ)
(Nitrato de potássio)
b) 2 HCl(aq) + Ca(OH)2(aq) → CaCl2(aq) + 2 H2O(ℓ)
(Cloreto de cálcio)c) H2SO4(aq)+ 2 NaOH(aq) →Na2SO4(aq) + 2 H2O(ℓ)
(Sulfato de sódio)d) H2SO4(aq)+ Mg(OH)2(aq) → MgSO4(aq) + 2 H2O(ℓ)
(Sulfato de magnésio)e) 2 H3PO4(aq)+ 3 Ba(OH)2(aq) →Ba3(PO4)2(aq) + 6 H2O(ℓ)
(Fosfato de bário) -
Questão 4
(Unisinos-RS) Ao participar de uma festa, você pode comer e beber em demasia, apresentando sinais de má digestão ou azia. Para combater a acidez, ocasionada pelo excesso de ácido clorídrico no estômago, seria bom ingerir uma colher de leite de magnésia, que irá reagir com esse ácido.
A equação que representa a reação é:
a) Mg(OH)2 + 2 HClO → Mg(ClO)2 + 2 H2O.
b) Mg(OH)2 + 2 HCl → MgCl2 + 2 H2O.
c) Mg(OH)2+ 2 HClO3 → Mg(ClO3)2 + 2 H2O.
d) Mn(OH)2+ 2 HClO2 → Mn(ClO2)2 + 2 H2O.
e) Mn(OH)2+ 2 HCl → MnCl2 + 2 H2O.
Alternativa “b”.
-
Questão 5
(Enem-MEC) Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico, H2SO4(aq), foram derramadas pelo navio Bahamas no litoral do Rio Grande do Sul. Para minimizar o impacto ambiental de um desastre desse tipo, é preciso neutralizar a acidez resultante. Para isso, pode-se, por exemplo, lançar calcário, minério rico em carbonato de cálcio, CaCO3(s), na região atingida.
A equação química que representa a neutralização do H2SO4(aq) por CaCO3(s) com a proporção aproximada entre as massas dessas substâncias é:
H2SO4 + CaCO3 → CaSO4 + H2O + CO2
1 tonelada reage com 1 tonelada sólido sedimentado gásPode-se avaliar o esforço de mobilização que deveria ser empreendido para enfrentar tal situação, estimando a quantidade de caminhões necessária para carregar o material neutralizante. Para transportar certo calcário que tem 80% de CaCO3, esse número de caminhões, cada um com carga de 30 toneladas, seria próximo de:
a) 100.
b) 200.
c) 300.
d) 400.
e) 500.
Alternativa “d”.
A reação mostra que para neutralizar 10 000 toneladas de ácido sulfúrico, são necessárias 10 000 toneladas de carbonato de cálcio puro. O calcário contém 80% de carbonato de cálcio.
10 000 toneladas de calcário -------- 80% de CaCO3
x -------------------- 100% de CaCO3
x = 100 . 10 000 → x = 12 500 toneladas de calcário
801 caminhão ----------- 30 toneladas
y ------------ 12 500 toneladas
y = 12 500 → y = 417 caminhões.
30 -
Questão 6
(UFRRJ) A tabela a seguir mostra alguns sais e suas principais aplicações:
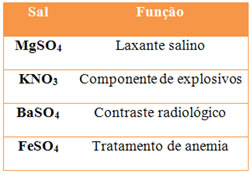
Para cada um dos sais acima, faça uma reação de um ácido com uma base, a fim de obter:
a) Sulfato de magnésio.
b) Nitrato de potássio.
c) Sulfato de bário.
d) Sulfato de ferro II.a) H2SO4(aq)+ Mg(OH)2(aq) → MgSO4(aq) + 2 H2O(ℓ)
(Sulfato de magnésio)
b) HNO3(aq)+ KOH(aq) → KNO3(aq)+ H2O(ℓ)
(Nitrato de potássio)c) H2SO4(aq) + Ba(OH)2(aq) →BaSO4(aq) + 2 H2O(ℓ)
(Fosfato de bário)d) H2SO4(aq) + Fe(OH)2(aq) → FeSO4(aq) + 2 H2O(ℓ)
(Sulfato de ferro II)