Exercícios sobre reações de oxirredução com a água oxigenada
Estes exercícios sobre reações de oxirredução com a água oxigenada testarão seus conhecimentos sobre as particularidades dessa ocorrência.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
Considere a equação balanceada a seguir:
Cr2O7-2(aq) + 3H2O2(l) + 8H+(aq) → 2Cr3+(aq) + 3 O2(g) + 7 H2O(l)
Podemos afirmar que o peróxido de hidrogênio atua no processo como:
a) uma molécula cuja carga total é -2
b) uma molécula cuja carga total é -1.
c) uma substância que sofre oxidação.
d) Agente redutor.
e) Agente oxidante.
Letra d). Para determinar a classificação do peróxido de hidrogênio, é fundamental determinar o NOX de cada um dos átomos dos elementos presentes na equação:
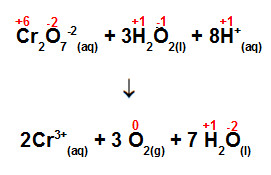
Analisando a equação, observa-se que o NOX do elemento crômio varia de +6 para +3, sendo o Cr2O7-2 o agente oxidante. Já o oxigênio possui NOX -1 no peróxido de hidrogênio e, no produto, NOX 0 e -2. Como o crômio é o agente oxidante, consideramos que o oxigênio varia seu NOX de -1 a 0, sendo o peróxido de hidrogênio, portanto, o agente redutor.
-
Questão 2
Considere as equações químicas a seguir:
I- 1 H2O2(aq) + 2 I-(aq) + H+(aq) → 2 H2O(l) + 1 I2(s)
II- 2 CrCl3+ 10 NaOH + 3 H2O2 → 2 Na2CrO4 + 6 NaCl + 1 H2O
III- 1 Ag2O + 1 H2O2 → 2 Ag + 1 H2O + 1 O2
IV- 1 H2O2(aq) + 2 I-(aq) +2 H+(aq) → 2 H2O(l) + 1 I2(s)
V- 5 H2O2 + 2 MnO4- + 6 H+ → 5 O2 + 2 Mn2+ + 8 H2O
Em quais delas a água oxigenada atua como agente redutor?
a) I e II.
b) I e III.
c) II e IV.
d) IV e V.
e) III e V.
Letra e). A água oxigenada, ou peróxido de hidrogênio, atua como agente redutor sempre que no produto de uma reação em que ela está presente no reagente temos a presença do gás oxigênio (O2).
-
Questão 3
(UEL-PR) O peróxido de hidrogênio puro é líquido, incolor, xaroposo e muito reativo. É comercializado como reagente químico em solução aquosa e, dependendo da concentração, pode ser empregado como antisséptico ou como alvejante.
Considere as duas seguintes equações não equilibradas como exemplos de reações que ocorrem ao se utilizar o peróxido de hidrogênio e analise as afirmativas a seguir:
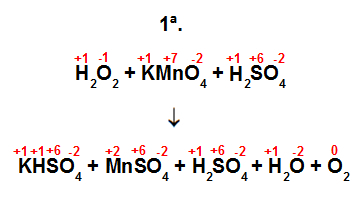
1a equação: H2O2 + KMnO4 + K2SO4 → KHSO4 + MnSO4 + H2SO4 + H2O + O2
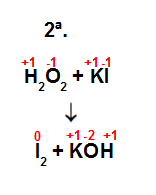
2a equação: H2O2 + KI → I2 + KI
I. O peróxido de hidrogênio é agente redutor em ambas as equações.
II. O peróxido de hidrogênio atua como agente redutor na primeira reação e como agente oxidante na segunda reação.
III. O número de elétrons envolvidos na semirreação do peróxido de hidrogênio na segunda reação é 2.
IV. A soma algébrica dos coeficientes mínimos inteiros para a primeira reação equilibrada é 26.
São corretas as afirmativas:
a) I, III e IV.
b) II, III e IV.
c) II e III.
d) I e III.
e) II e IV.
Letra a). Os itens I, III e IV estão corretos. Para comprovar isso, é necessário fazer o seguinte:
Passo 1: determinação do NOX de cada elemento em cada fórmula de cada equação.
Passo 2: determinar quem é o agente oxidante e redutor de cada equação.
Para a equação 1:
-
O agente oxidante é o KMnO4, pois o NOX do Mn passa de +7 a +2;
-
O agente redutor é o H2O2, pois o NOX do O passa de -1 a 0.
Para a equação 2:
-
O agente oxidante é o KI, pois o NOX do I passa de -1 a 0;
-
O agente redutor é o H2O2, pois o NOX do O passa de -1 a +1.
Passo 3: determinar a variação de NOX (subtrair o NOX do reagente pelo NOX do produto para descobrir os elétrons presentes na oxidação e na redução) em cada equação:
Variação na equação 1:
-
Para o KMnO4: Δ = 7-2 = 5
-
Para o H2O2: Δ = 0-(-1) = 1
Variação na equação 2
-
Para o KI: Δ = 0-(-) = 1
-
Para o H2O2: Δ = 1-(-1) = 2
Passo 4: determinar os valores que iniciam o balanceamento multiplicando a variação de NOX do elemento pelo seu índice na fórmula da substância.
Na equação 1:
-
Para o KMnO4: 1.5 = 5 (5 elétrons recebidos)
-
Para o H2O2: Δ = 2.1 = 2 (2 elétrons perdidos)
OBS.: O valor encontrado no KMnO4 será utilizado no H2O2 e vice-versa para que a quantidade de elétrons perdidos e recebidos seja a mesma.
Na equação 2:
-
Para o KI: 1.1 = 1 (1 elétron recebido)
-
Para o H2O2: Δ = 2.2 = 4 (4 elétrons perdidos)
Passo 5: terminar o balanceamento das equações pelo método da tentativa.
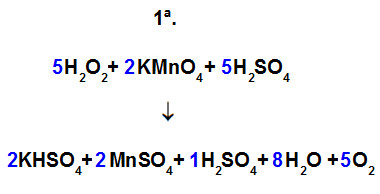
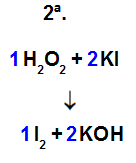
-
-
Questão 4
(F.M. Pouso Alegre-RS) Considere a equação da reação descrita a seguir:
H2O2 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + H2O + O2
Após o balanceamento, todas as alternativas abaixo estão corretas, exceto:
a) o coeficiente do sulfato de potássio é 1.
b) a soma dos coeficientes da água oxigenada e do oxigênio é 10.
c) o coeficiente do ácido sulfúrico é 3.
d) o coeficiente da água oxigenada é 8.
e) a soma dos coeficientes do permanganato de potássio e do sulfato de manganês é 4.
Letra d).
Passo 1: determinação do NOX de cada átomo.
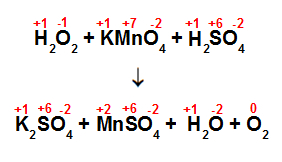
Passo 2: determinar o agente oxidante e redutor de cada equação.
-
O agente oxidante é o KMnO4, pois o NOX do Mn passa de +7 a +2;
-
O agente redutor é o H2O2, pois o NOX passa de -1 a 0.
Passo 3: determinar a variação de NOX (subtrair o NOX do reagente pelo do produto para descobrir os elétrons presentes na oxidação e na redução) em cada equação:
-
Para o KMnO4: Δ = 7-2 = 5
-
Para o H2O2: Δ = 0-(-1) = 1
Passo 4: determinar os valores que iniciam o balanceamento multiplicando a variação de NOX do elemento pelo seu índice na fórmula da substância.
-
Para o KMnO4: 1.5 = 5 (5 elétrons recebidos)
-
Para o H2O2: Δ = 2.1 = 2 (2 elétrons perdidos)
OBS.: O valor encontrado no KMnO4 será utilizado no H2O2 e vice-versa para que a quantidade de elétrons perdidos e recebidos seja a mesma.
Passo 5: terminar o balanceamento das equações pelo método da tentativa.
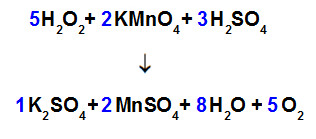
-
